研究・開発の窓 COLUMN
34万種の公的化合物ライブラリーとスクリーニング支援で、アカデミア発の創薬を推進する
東京大学大学院薬学系研究科附属創薬機構・小島宏建特任教授
 東京大学は、2006年から公的な化合物ライブラリーとスクリーニング施設を管理・運営している。現在では34万種の化合物を所蔵するライブラリーとなっているが、熱意ある創薬研究者には、産学官いずれの組織に所属しているかを問わず、誰にでも開放していることが大きな特徴だ。副機構長を務める小島宏建特任教授に、公的化合物ライブラリーの重要性や同機構が展開する創薬支援事業について聞いた。
東京大学は、2006年から公的な化合物ライブラリーとスクリーニング施設を管理・運営している。現在では34万種の化合物を所蔵するライブラリーとなっているが、熱意ある創薬研究者には、産学官いずれの組織に所属しているかを問わず、誰にでも開放していることが大きな特徴だ。副機構長を務める小島宏建特任教授に、公的化合物ライブラリーの重要性や同機構が展開する創薬支援事業について聞いた。
小島特任教授のもともとの研究テーマは、バイオイメージングであり、新規に開発した生体内のNO(一酸化窒素)を検出する蛍光プローブは試薬として市販され、循環器系、神経系、免疫系など生体内でのNOの働きを解明するために役立てられている。また、近赤外線に反応して発光する蛍光色素を合成し、生体内の深い部分までイメージングする技術も開発している。
小島特任教授の創薬支援への関わりは、2006年に所属していた研究室の長野哲雄教授(現東京大学名誉教授)が、タンパク質の構造解析の出口戦略としてのアカデミア創薬を支援する文部科学省のプロジェクトの一環として、低分子化合物ライブラリーを構築する構想を打ち出したことに始まる。
医薬品の探索研究では、標的分子に対して数万、数十万の化合物ライブラリーから薬理活性を持つ化合物を網羅的に探索するハイスループットスクリーニング(HTS)技術が誕生し、日本でも主要な製薬企業は1990年代にこの技術を導入した。
しかし、日本のアカデミアでは「2000年代に入ってもHTSの設備も技術もなく、創薬標的分子を持つ研究者は多いのに、探索研究の振り出しから前に進むことができない状態が続いていた」と小島特任教授は当時の問題点を指摘する。また、ヒット化合物から薬理活性の高いリード化合物を創出し、最適化して医薬品候補化合物にするような創薬化学的な研究もほとんど行われていなかった。
米国ではアカデミアやベンチャー発の創薬シーズから数多くの新薬が誕生している、2004年にはNIH主導で公的なMolecular Library Initiativeが スタートし、70以上の研究機関が化合物ライブラリーとスクリーニング基盤を有し、10万種以上を所蔵する機関も数多くあったという。
小島特任教授は「日本でもこのような創薬基盤が必要であり、そのために創設された東大創薬機構は、最先端の基礎研究から生まれた創薬アイデアを、研究者と一緒にシーズに磨き上げることを使命としている」と強調する。

東大創薬機構には、大手製薬企業と同等の2つの自動倉庫(原末サンプルと溶液サンプルの保管庫)、入出庫用ロボット、HTSを可能にするオートメーションシステム、各種測定分析装置などが整い、所蔵する化合物数は計34万種(図1)に達する。
また、2016年には構造展開ユニットを新設し、ヒット化合物の薬理活性、物性、動態などを改善してリード化合物を創出する支援事業も開始した。現在、同機構は25人程度のスタッフで運営されているが、そのうち20人以上が製薬企業で勤務経験があり、企業のノウハウをアカデミアに適応させながら支援を続けている。
同ライブラリーを利用したい研究者は、同機構に申請書を提出し、コンサルティングを受けた後、希望する化合物サンプルの提供を受け、それを使って自身でヒット化合物をスクリーニングする。自身の所属する大学等に設備が整っていればそこで実施してもよく、希望すれば同機構の設備を利用することもでき、スクリーニング技術習得の支援を受けることも可能だ。
化合物サンプルそのものの提供費用は無料であるが、マイクロプレートなどの容器類やクール宅配便の費用は実費となる(図2)。
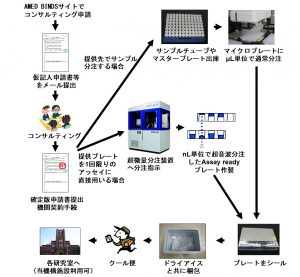
小島特任教授は「数多くスクリーニングすればヒットする確率は高くなるが、アカデミアの研究者には費用の限界がある。そこで構造多様な代表的な1万種をコア・ライブラリーとして最初に提供し、次に推奨する2万2000個を提供し、あとは標的や研究目的に応じて提供するといった形で運用を工夫している」と話す。
ライブラリーの中には、製薬企業から寄託された化合物サンプルも含まれる。研究者にとっては企業のライブラリーにアクセスでき、企業にとってはアカデミア発の最新標的に対し、いち早く自社の化合物をスクリーニングできるメリットがあり、ヒット化合物を持つ企業とアカデミアの共同研究にもつながる。
また、AMEDから創薬支援事業で構築された中分子化合物ライブラリー(タンパク質間相互作用阻害候補物質・計5万6000サンプル)の移管を受けたため、中分子化合物のスクリーニングも可能になった。
2012年から始まった文部科学省のアカデミア創薬研究基盤整備事業により、東京大学を含めた全国7大学で誰もが使用できるHTS設備と化合物ライブラリーが整備された。東大以外の化合物ライブラリーは小規模であるが、各地域でアカデミア創薬の基盤は整いつつある。近隣の拠点大学で1万種程度の化合物スクリーニングをした後、東大創薬機構からさらに化合物サンプルの追加提供を受けることも可能だ。
ただ、小島特任教授は「アカデミア創薬に必要な設備は整ったが、ヒット化合物を見出すためには目的に即したアッセイ系構築が必要。HTSの作業はそれほどの時間はかからないが、アッセイ系構築に数カ月~1年かかるのが普通だ。研究者に対するスクリーニング技術教育やコンサルティングが最も重要だと感じている」と指摘する。同機構では、基本的なスクリーニングや専門テーマ別の講習会を連続的に開催しているほか、実地の個別指導も行っている。
2022年3月までに、同機構の化合物提供について問い合わせてきた研究者は計1121人で、そのうち795人にサンプルが提供された。同機構が支援した研究は、すでにいくつかの成果を生み出している。
2014年には同機構の化合物ライブラリーから見出し、構造改変したオートタキシン(臓器の線維化や炎症等に関わる酵素)の阻害作用を有する化合物を、塩野義製薬に導出した。腎臓病等の治療薬創出につながるシーズとして期待された。
また、支援の過程で開発されたのが、がんなどさまざまな病態に関わる生体内分子である糖転移酵素群やリン酸化酵素に反応する蛍光プローブで、和光純薬工業から2015年に測定試薬として発売された。従来からある同種の発光アッセイ法はコストが高く、アカデミア研究者が行う大規模化合物スクリーニングに使用できるものではなかったが、新規の試薬を用いるとコストを劇的に下げられるという。
小島特任教授は「これまでの経験を通じて、アカデミアと企業の創薬に対する考え方には乖離があり、それを埋めていく知恵が重要であることを学んだ」と話す。最も大きな違いは、アカデミアの研究者は論文をアクセプトすることを優先することだ。企業ならまだ秘匿する段階であっても、アカデミアでは論文掲載の実績で研究費を獲得する現実がある以上、避けて通ることはできない。
両者のギャップを埋めた一例として、「オートタキシン阻害剤では、研究者は2番目に優れた化合物の実験結果をもとに論文を書き、秘匿した最も優れた化合物を製薬企業に導出する戦略を採った」と小島特任教授は舞台裏を明かす。他にも、データの再現性や信頼性、研究のスピード、知的財産権(強い特許)の確保などいくつかの面で、アカデミアと企業が求めるレベルには相違があることから、アカデミア側の理解促進や企業との調整に力を注いでいる。
また、創薬標的の枯渇が指摘される昨今だが、リスクの高い創薬にも取り組めるアカデミアの利点を生かし、今後の目標として「疾病との関連が不明確なテーマにも着手してPOC取得を目指す」、「フェノタイプ(表現型)スクリーニングによる創薬と標的の同定」、「希少・難治疾患の治療薬の研究開発」、「人材育成」などを掲げる。「公的化合物ライブラリーを運営開始して15年以上になるが、まだアカデミアや企業に広く周知できているとはいえない。創薬を夢見る幅広い研究者に利用していただきたい」と小島特任教授は話している。
過去の記事
-
新たに確立した神経変性疾患モデルラットを用いて病態メカニズムを解明

大阪公立大学大学院 獣医学研究科 准教授 田中美有氏 -
転写因子も創薬標的にできる新たなモダリティ「PROTAC」研究を推進

国立医薬品食品衛生研究所 有機化学部 部長 出水庸介氏 -
新しい理論「生物力学」とAIを活用した汎用疾患予測モデルを開発

慶応義塾大学医学部 教授 桜田一洋氏(石井・石橋記念講座/拡張知能医学) -
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏



