研究・開発の窓 COLUMN
プロスタグランジン産生機構の研究から、新たなNSAIDsや抗がん薬の標的を見つける
昭和大学薬学部 原 俊太郎教授(社会健康薬学講座衛生薬学部門)
 NSAIDs(非ステロイド性抗炎症薬)は、アラキドン酸の代謝経路で働くシクロオキシゲナーゼ(COX)を阻害してプロスタグランジン類の産生を抑制し、解熱、鎮痛、抗炎症効果を発揮する薬だ。昭和大学薬学部の原俊太郎教授(社会健康薬学講座衛生薬学部門)らは、今日的な手法でプロスタグランジン産生機構の研究を推し進め、副作用の少ないNSAIDsや、新しい作用を有する薬の開発につながる創薬標的を見出す研究を続けている。
NSAIDs(非ステロイド性抗炎症薬)は、アラキドン酸の代謝経路で働くシクロオキシゲナーゼ(COX)を阻害してプロスタグランジン類の産生を抑制し、解熱、鎮痛、抗炎症効果を発揮する薬だ。昭和大学薬学部の原俊太郎教授(社会健康薬学講座衛生薬学部門)らは、今日的な手法でプロスタグランジン産生機構の研究を推し進め、副作用の少ないNSAIDsや、新しい作用を有する薬の開発につながる創薬標的を見出す研究を続けている。
衛生薬学は、疾病予防や健康保持を目的に、環境中にあるさまざまな化学物質、食品・栄養、毒物・薬物などを研究する「生を衛る」学問分野である。昭和大学薬学部の社会健康薬学講座衛生薬学部門(旧衛生化学教室)は1964年に創設され、糖質や脂質の生理活性と健康との関連、特に先代の工藤一郎教授の就任以降は、細胞膜を構成する主要な脂質の一つ、アラキドン酸の代謝反応を中心に研究を進めてきた。
2009年から教授を務める原俊太郎氏は、「環境と疾病の関係を研究することこそが衛生薬学である。環境中の物質が影響して代謝系が破綻し、疾患の発症や増悪につながることを解明したいと考え、私の代になってもアラキドン酸代謝系を研究テーマの中心に据えている」と語る。
原教授がアラキドン酸代謝とプロスタグランジン産生機構に興味を持ったのは、東京大学薬学部の学生時代に遡る。東大に入って間もない1982年に、ベリストローム、サミュエルソン、ベーンの3博士がプロスタグランジン産生機構の研究でノーベル賞を受賞したことに刺激を受け、「NSAIDsが脂質の代謝酵素を一つ抑えるだけで多くの作用を発揮することに強い関心を持ち、脂質の研究ができる東大の衛生化学裁判化学教室(現衛生化学教室)に入った」という。
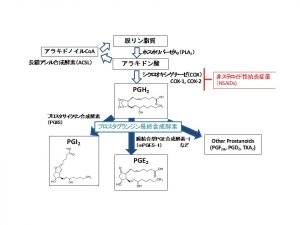
生体の細胞膜からアラキドン酸が遊離し、数段階の化学反応を経てプロスタグランジン類が産生される経路(アラキドン酸カスケード)は図1の通りだが、原教授は40年近く、この1枚のチャートに出てくるさまざまな代謝物や酵素の研究を重ねてきた。
東大の博士論文はこの代謝系の最上流に位置するホスホリパーゼA2に関するもので、次に入った国立循環器病センター研究所では、最終代謝物の中で血栓形成に関与するトロンボキサンA2(TXA2)、血栓抑制に関与するプロスタサイクリン(PGI2)の研究に携わった。
アラキドン酸代謝に関わる主要な酵素や代謝物は数十年前に発見され、構造や生理活性も解明されているが、原教授は、「昔の研究では、反応に関わる種々の酵素の中で1つだけを阻害するのは難しかったが、今日では分子生物学が発展し、同定した酵素の遺伝子をノックアウトするなどの手法で、一つ一つの分子の機能を別々に解析することができるようになった。また、脂質の分析技術も進化したため、まだ発見されていない未知の脂質(代謝物)が見つかる可能性もある」と説明する。
周知のように、NSAIDsには消炎鎮痛作用とともに、胃潰瘍などの副作用がある。これは、アラキドン酸の最終代謝物の1つであるプロスタグランジンE2(PGE2)が胃粘膜保護や腎臓機能の調節といった善玉作用、炎症や発熱、がんなどに関わる悪玉作用の両面を持つためである。NSAIDsはアラキドン酸が中間代謝物であるプロスタグランジンH2(PGH2)に変換される過程で働くCOX(COX-1とCOX-2の両方)を阻害し、最終的にPGE2の産生を抑制し、悪玉作用と同時に善玉作用も失わせるため、消化器系副作用が出るとされている。
1990年代初めにCOXのサブタイプであるCOX-2の発見、構造解明がなされ、COX-1が胃粘膜保護や腎臓機能調節に、COX-2が炎症やがんの発生に関与することが明らかになり、消化器系副作用を抑制できると考えられる選択的COX-2阻害薬が開発された。しかし、選択的COX-2阻害薬は消化器系副作用が少ない反面、心血管系副作用が多発し、複数の新薬が販売中止となり、日本ではセレコキシブのみが使用されている。
原教授は「COX-2は悪玉作用を示すPGE2だけでなく、PGI2を生合成する反応にも関わっている。そのため、特異的にCOX-2を阻害すると血小板凝集抑制・血管拡張作用を有するPGI2が減少し、逆の作用を有するTXA2とのバランスが崩れて血栓ができやすくなる」と説明するとともに、「そこで、新しいNSAIDsはCOXではなく、プロスタグランジンの最終合成酵素を標的にするという考え方で研究を重ねてきた」と戦略を述べる。
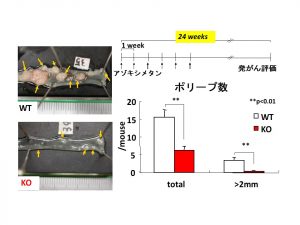
標的の一つは、アラキドン酸代謝系の最終段階で働くPGE2合成酵素。その中でも悪玉作用を示すPGE2の産生を担う膜結合型PGE合成酵素-1(mPGES-1)という酵素である。原教授らはこのmPGES-1に着目し、mPGES-1遺伝子ノックアウトマウスを使ってさまざまな実験を行ってきた。その結果、mPGES-1が欠損すると、疼痛反応の抑制、関節炎の抑制、がん細胞の増殖・転移の抑制、大腸の発がん抑制(図2)、アルツハイマー病様症状の軽減などが起きることを明らかにして、それぞれ論文発表した。
「アスピリンなどのNSAIDsにがん抑制作用があることは知られているが、副作用もある。mPGES-1阻害薬を開発することができれば、副作用の少ない抗炎症薬、副作用の少ないがんの予防・治療薬として期待できる」と原教授。マウスとヒトとの種差やバイオアベイラビリティの問題もあり、まだ、mPGES-1阻害薬は世に出ていないが、「いくつかの製薬企業が研究を継続しているようだ」という。
また、原教授は環境中の化学物質がアラキドン酸代謝系に及ぼす影響も研究しているが、その面から最近、着目しているのが、やはりアラキドン酸代謝系の最終段階でPGI2を合成する酵素(PGIS)である。マウスに抗がん薬シクロホスファミドを投与すると出血性膀胱炎を発症するが、PGISノックアウトマウスではシクロホスファミドを投与後も出血性膀胱炎が見られなかった。
この実験ではPGIS阻害による抗がん薬の副作用軽減の可能性が示されたが、原教授は「アラキドン酸代謝系の最終合成酵素には多くの種類がある。それらの中から、別の薬の副作用を軽減できる薬や、全く新しい作用を有する薬につながる標的を見つけることができるのではないかと考えている」と展望を語る。
一つのものにこだわり、深く研究し続けることで、新たな広がりが見えてくる。そう話す原教授のアラキドン酸代謝系研究は、これからも続く。
過去の記事
-
薬物の代謝速度や相互作用に関与

する小胞体膜トランスポーターの機能を
解明する
名古屋市立大学大学院 薬学研究科 教授 荒川大氏 -
消化管全体の生理環境と薬物動態を考慮した革新的な薬物吸収性予測モデルを開発する

昭和薬科大学 薬学部 教授 白坂善之氏
(薬剤学研究室) -
プロテオーム解析を起点に老化関連疾患の病態機序や健康長寿の因子を探索

東京都健康長寿医療センター研究所 研究部長 三浦ゆり氏(老化機構研究チーム プロテオーム研究) -
バイオ医薬品の経口投与や効率的脳内移行を実現する「組織関門透過ペプチド」を発見

熊本大学大学院 生命科学研究部 准教授
伊藤慎悟氏 -
食品の機能性成分を分子・細胞レベルで解析し、「食による病気の予防」を目指す

群馬大学大学院 食健康科学研究科・理工学府 教授 薩秀夫氏