研究・開発の窓 COLUMN
細胞を使ったものづくり、独自の臓器設計技術で日本の新たな産業を切り開く
横浜市立大学大学院 小島伸彦准教授(生命ナノシステム科学研究科・生命環境システム科学専攻・再生生物学研究室)
 再生医療や新しい創薬基盤には、ヒトや動物の細胞から臓器をデザインする技術が欠かせない。横浜市立大学大学院で再生生物学研究室を主宰する小島伸彦准教授は、スフェロイドやオルガノイドと呼ばれるような、いわゆる「細胞凝集体」の設計技術開発、「細胞を使ったものづくり」を研究テーマとしている。
再生医療や新しい創薬基盤には、ヒトや動物の細胞から臓器をデザインする技術が欠かせない。横浜市立大学大学院で再生生物学研究室を主宰する小島伸彦准教授は、スフェロイドやオルガノイドと呼ばれるような、いわゆる「細胞凝集体」の設計技術開発、「細胞を使ったものづくり」を研究テーマとしている。
小島准教授は、「最終的には本物そっくりの臓器を創り、移植医療や創薬に役立てることが目標だが、同時に本物そっくりでなくても世の中の役に立つものが創れるとも感じているため、自由な発想でデザインしている」と話す。
小島准教授がイメージする臓器設計技術は、ガラス細工の「トンボ玉」のように、単純な材料から内部に複雑な模様(構造)を有した作品(細胞凝集体)を創り上げることだ。バラバラの懸濁細胞を、付加価値の高い細胞凝集体に組み上げるための方法を探ってきた。
「木や石、金属を使ったものづくりが産業の基盤となったように、細胞を使ったものづくりが将来の日本を背負う産業になると信じている」と力強く語る。
小島准教授が開発した技術の一つは、細胞接着力が弱い細胞からスフェロイドを創る方法である。一般的に、U底プレートに細胞懸濁液を入れると、重力で沈降して細胞自身の接着力によって凝集するが、接着力の弱い細胞は凝集しない。
例えば、市販されている凍結ヒトiPS細胞由来肝細胞は、接着力の低いものが多いという。小島准教授らが開発した技術は、高粘度のメチルセルロース培地中に、細胞を懸濁した低粘度培地をマイクロピペットで強制的に吐出するという方法。高粘度培地の中で、10分程度で細胞だけが凝集し、12~24時間程度で接着する。小島准教授らは、この方法でスフェロイド形成したヒトiPS細胞由来肝細胞は、平面培養した場合よりもCYP3A4などの代謝酵素の遺伝子発現量がはるかに多いことを確かめている。
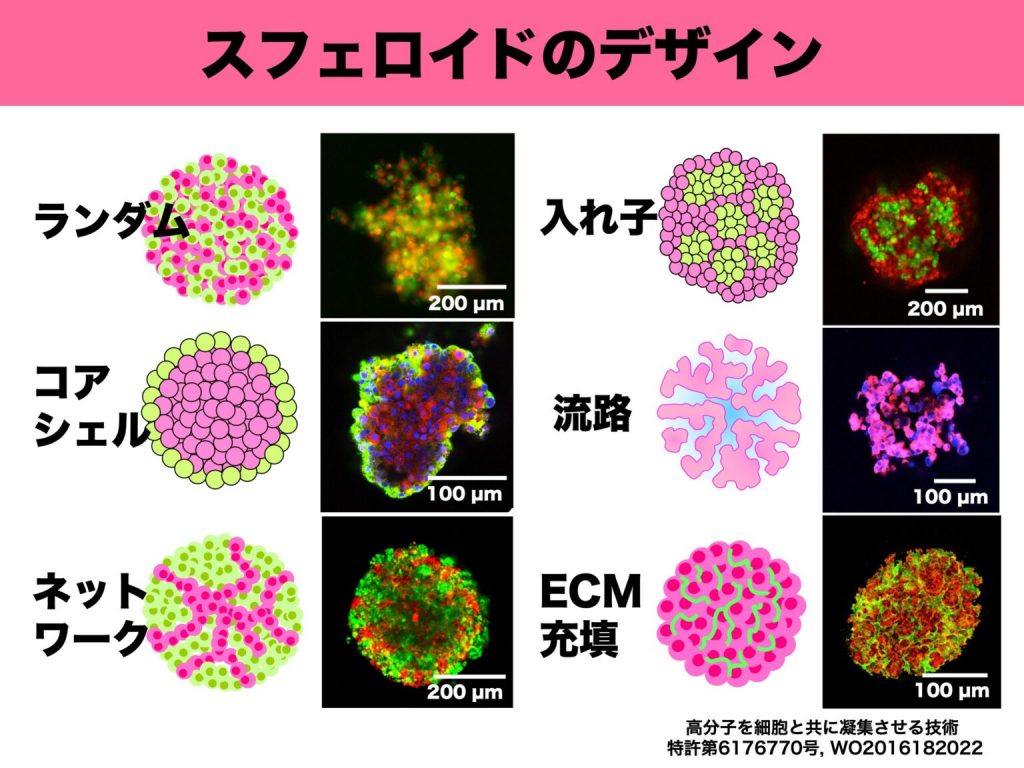
では、スフェロイドのデザインにはどのようなものがあるのか。図1に示したのが、小島准教授らが作成したデザインの一例だ。
左上の「ランダム」は、2種類の細胞を混合しただけのスフェロイド。しかし、多くの場合、ランダムのまま維持されることはなく、細胞は生体内に近い形に位置を変化させる。左中の「コアシェル」は内部の赤がマウスの膵β細胞、外側の緑が膵α細胞であり、単純に混合培養しただけで、マウスの膵島細胞と同じ形に自然に並び変わるという。
また、左下の「ネットワーク」は、緑が肝細胞、赤が血管内皮細胞であるが、血管内皮細胞が血管のネットワークのように位置を変化させている。 一方、右側の3例は人為的に構築したデザインだ。右上の「入れ子」構造は、ヒトの膵島細胞を模したスフェロイドだ。ヒトの膵島細胞はマウスのような単純構造ではないが、先に緑の細胞(β細胞をイメージ)で小さなスフェロイドを造ってから、次の工程で緑の細胞からなる複数個の小スフェロイドと分散状態の赤の細胞(α細胞をイメージ)を凝集させることで、類似した構造を再現することが可能である。
右中の「流路」は、細胞とともにハイドロゲルビーズを凝集させることにより形成したスフェロイド。ハイドロゲルビーズを酵素で溶かせば、その部分が流路となり、細胞に酸素や栄養などを供給できる。これは肝小葉の構造によく似ている。小島准教授は「スフェロイドは中心部分の細胞が壊死しやすいことが問題点だったが、流路を形成することで壊死が少なくなり、より長期間利用できる。肝細胞スフェロイドは薬の毒性試験への活用が期待されているが、酸欠などによる壊死が防げれば、薬の毒性がより判定しやすくなる」と有用性を説明する。
最後の「ECM(細胞外マトリックス)充填」は、細胞とともにコラーゲンなどのECMを凝集させたスフェロイド。肝硬変など線維化した疾患臓器モデル、加齢臓器モデルに応用することを想定している。
小島准教授らはECM充填技術を応用して、1型糖尿病モデル膵島を作成した。1型糖尿病では膵島にヒアルロン酸が蓄積していることが知られている。そこで、マウス初代膵島細胞とヒアルロン酸からなるスフェロイド(擬似膵島)を作成し、膵島細胞だけで再構成したスフェロイドとインスリン分泌量を比較すると、ヒアルロン酸充填群は明らかに低下していた。このことから「初期の1型糖尿病に対する薬の開発や疾患進行抑制の研究に役立つのではないか」と話している。
また、現在、海外で行われている1型糖尿病患者へのブタ膵島移植への応用も考えられる。この治療では、拒絶反応を免れるためにブタ膵島細胞を特殊なカプセルで包んで移植するが、カプセル化すると血管から細胞に酸素や栄養素が届かず、1~数年で機能が低下することが指摘されている。
小島准教授は、ブタ膵島細胞をいったんバラバラにしてハイドロゲルビーズととともにスフェロイド形成することで、膵島細胞の機能を長期に維持できる可能性があると指摘する。「本物の臓器ではない方が適しているケースもある。ジャンプに特化した義足を付けたパラアスリートが、健常人より遠くに跳ぶことがあるのと同じだ」。
こうした発想をさらに飛躍させ、小島准教授が進めているのが、フェニルケトン尿症への「液体肝臓」治療の開発だ。アミノ酸の一つであるフェニルアラニンは、肝臓でフェニルアラニン水酸化酵素(PAH)によりチロシンに代謝されるが、先天的にPAH遺伝子が欠損した同症では、フェニルアラニンが蓄積し、重度の精神発達障害を生じる。
疾患自体は新生児マススクリーニングで発見できるが、今の治療法は厳格なタンパク制限食を一生涯続けることしかない。原理としては肝臓移植で治癒するが、食事制限で病態をコントロールする方法に比べ、リスクが大きすぎるために行われていない。しかし、一生の間、タンパク質摂取を極端に制限することは、一人一人の患者やその家族にとっては本当に大変なことである。
小島准教授は「肝臓移植をもっとカジュアルにできないものか」と考え、①拒絶反応を誘導するHLA分子のない組織を利用、②肝臓の機能の一部だけを移植する、③血液中でもフェニルアラニンは代謝できる――という条件を満たす方法として、赤血球に代謝酵素PAHを封入して輸血することを発想し、「液体肝臓」と命名した。
赤血球に他の物質を封入する方法は、赤血球を低張液に浸してバーストさせ、等張液に戻すと周囲の物質を取り込んで元に戻る現象を利用した。試みると、比較的簡単に実現した。調べてみると、このような赤血球キャリアの研究は50年ほど前から存在し、海外では他のいくつかの疾患で臨床研究も行われていることが分かった。
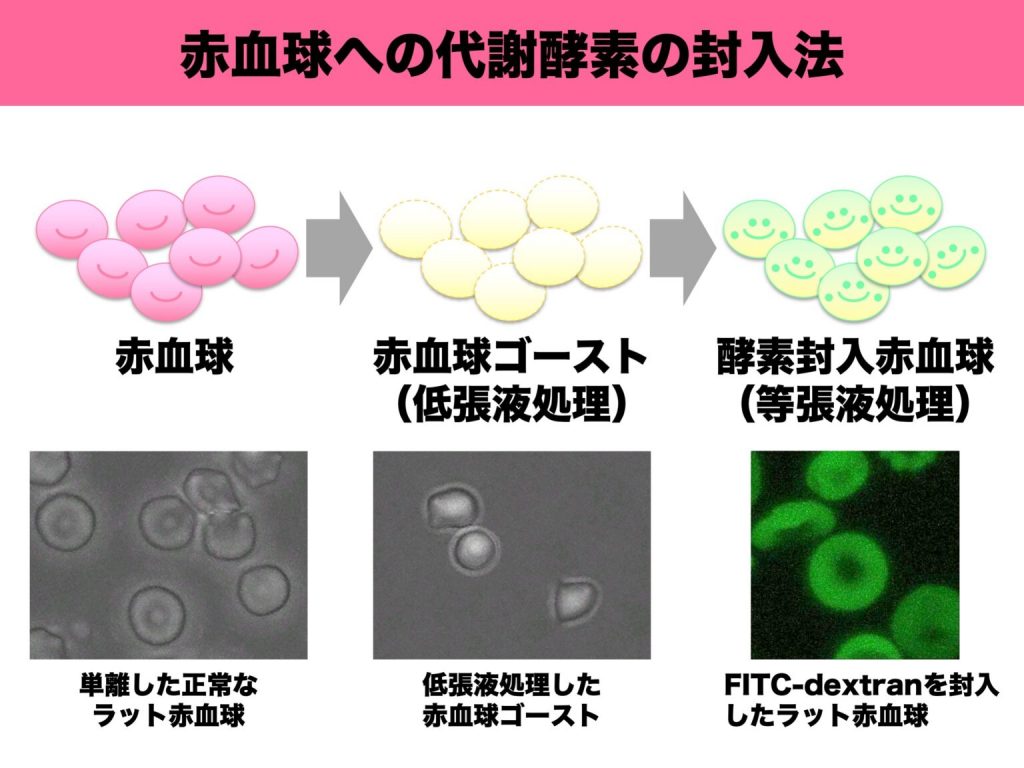
小島准教授が研究を進めている「液体肝臓」は、血液型が合えば免疫抑制剤は不要であり、がん化の問題もなく、120日程度で破壊されて再治療が必要になるが中断も可能であるといった、安全面で優れた特徴を持つ。
現在は、フェニルケトン尿症モデルマウスを使って、赤血球内に封入したPAHの活性を高める方法を研究中である。液体肝臓の実用化を進めるため、クラウドファンディングで研究資金を募ったところ、患者らを中心に1200万円を超える寄附が集まり、「患者さんたちの悩みや希望を直接聞くことができ、何としても実用化したいとの思いを新たにした」という。
一方、スフェロイドの研究成果を産業界に広げるため、2022年7月にベンチャー企業Ecocellを設立予定。小島准教授は「今後は細胞ベンダーとの協力関係を深めたい。われわれがベンダーから提供を受けた細胞をスフェロイドに加工し、ベンダーがユーザーに販売するといったビジネス展開が可能なのではないかと考えている」と展望を語った。
過去の記事
-
新たに確立した神経変性疾患モデルラットを用いて病態メカニズムを解明

大阪公立大学大学院 獣医学研究科 准教授 田中美有氏 -
転写因子も創薬標的にできる新たなモダリティ「PROTAC」研究を推進

国立医薬品食品衛生研究所 有機化学部 部長 出水庸介氏 -
新しい理論「生物力学」とAIを活用した汎用疾患予測モデルを開発

慶応義塾大学医学部 教授 桜田一洋氏(石井・石橋記念講座/拡張知能医学) -
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏




