研究・開発の窓 COLUMN
血液脳関門や腎臓・肝臓のトランスポーター研究を進め、薬物動態や相互作用を予測する
楠原洋之 東京大学大学院教授
 東京大学大学院の楠原洋之教授(薬学系研究科・分子薬物動態学)は、血液脳関門や肝臓、腎臓に存在するトランスポーターを介した薬物の生体膜透過機構の研究、それらを基盤とした薬物動態予測法および薬物相互作用予測法の研究で知られる。
東京大学大学院の楠原洋之教授(薬学系研究科・分子薬物動態学)は、血液脳関門や肝臓、腎臓に存在するトランスポーターを介した薬物の生体膜透過機構の研究、それらを基盤とした薬物動態予測法および薬物相互作用予測法の研究で知られる。
楠原教授は「薬は正しい組織に正しい量が届いて、初めて正しい効果を発揮するという考え方と、生体内のさまざまなパラメーターを用いて、血液や組織への薬物移行を数学で表現していく手法に魅力を感じ、杉山雄一先生(東京大学名誉教授)のご指導の下、薬物動態研究の道を歩み始めた」と研究者となった動機を語る。
楠原教授の研究の原点となったのが、血液脳関門の機構解明に関する研究だ。
「脳組織に薬物が届きにくいのは、血液脳関門と呼ばれる障壁があるからだが、関門の実態はよく分かっていなかった。薬物が移行しにくい理由の一つは、脳毛細血管の内皮細胞間の接着が強固(タイトジャンクション)であることが以前から知られていたが、それだけではないメカニズムがあるのではないかと感じていた」
楠原教授は大学院修士課程の時代に、寺崎哲也博士(東北大学名誉教授)の下で血液脳関門のトランスポーター研究を開始し、現在もその機構解明を研究テーマの一つとしている。
当時は、薬物動態の決定因子としてトランスポーターの分子実体が、実験動物やヒトで明らかにされつつあり、「各臓器で薬物動態に関与するトランスポーターが分かれば、開発段階の薬が当該トランスポーターの基質になるかどうかで、脳に移行しやすいのか、肝臓に移行しやすいのかなどを予測することができる」とその重要性を指摘する。
その後、楠原教授は博士課程時代に遠藤仁博士(杏林大学名誉教授)との共同研究で、腎臓に薬物が集まる機構解明の一環としてトランスポーターの探索研究を行い、アニオン性物質を運ぶトランスポーター分子の一つ有機アニオントランスポーター3(OAT3=Organic anion transporter)を見つけることができた。
その後の研究で、OAT3を含めたOATファミリーは、P-gp(P-glycoprotein)、BCRP(Breast cancer resistance protein)、OATP(Organic anion transporting polypeptide)などともに、脳、腎臓、肝臓などの薬物輸送に深く関与していることが分かっている。
血液脳関門の機構はどこまで解明されてきたのか。
楠原教授は、「血液脳関門では、トランスポーターによりアミノ酸や糖などの必要な物質を脳内に取り込む一方で、P-gpやBCRPが排出ポンプとして働き、脳組織側から血液側に薬物をくみ出していることが解明された。
この機構により、薬物を含めた異物が脳に移行するのを抑制している」と説明し、「P-gpやBCRPといったトランスポーターの基質にならないようデザインされた薬でなければ、効率的に中枢に移行できないということになる」と続ける。もともとP-gpやBCRPは腫瘍細胞で、抗がん剤への耐性獲得に関与するトランスポーターとして見つかったが、脳や腎臓、肝臓などでは正常細胞にも発現して異物排出に関与することが明らかになってきた。
血液脳関門や血液脳脊髄液関門で、脳組織側から血液中に異物が排出される過程は、厳密に言えば脳実質内・脊髄液内から血管内皮・上皮細胞内への取り込みと、血管内皮・上皮細胞内から血液中へのくみ出しの2段階がある。楠原教授のグループは、その両方の段階でOATファミリー、OATPファミリー、P-gp 、BCRP、MRP1などのトランスポーターが協関して働き、方向性のある輸送を達成することを明らかにしている(図1)。
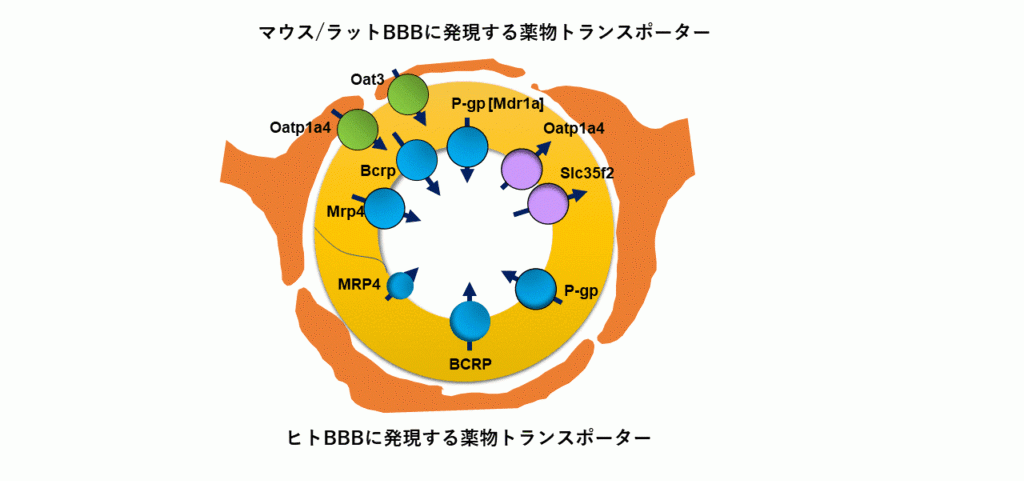
上半分がマウス/ラットの血液脳関門で発現しているトランスポーター、下半分が人の血液脳関門で発現しているトランスポーター
だが、不明な点も多く残っているという。例えば、血液中から脳組織に薬物が移行する過程でトランスポーターが関与しているのかどうかは、よく分かっていない。また、薬も低分子化合物から、抗体、核酸、ウイルス粒子へと拡張されていくなかで、どのようにデザインすれば、効率的に脳へ送達できるのか、よく分かっていない。
楠原教授らはマウスでは血液側から脳組織側への移行過程で発現するトランスポーターを確認しているが、ヒトではほとんど発現が確認されていないという。これは実験動物とヒトとの種差であり、実験動物を使った探索研究では、ヒトへの外挿性が課題になることも多い。ヒトの生体の機能を維持したin vitroモデルや外挿性の高い実験動物の確立が重要である。
血液脳関門、肝臓や腎臓の薬物吸収・排出の機構解明には、近年ではヒトの初代培養細胞やiPS由来細胞などヒト由来試料を用いることで、ヒト薬物動態に関する情報を入手することが容易となった。
その一方で、楠原教授は「作成したin vitroモデル細胞と生体の細胞では、薬物動態学的な機能に違いが出てしまうことがある。細胞は置かれた環境に適応しようとするので、培養するうちに生体内にあったときの性質や機能を失ったり、あるいは獲得したりしてしまう。どうすれば生体内にあったときの性質や機能に近づけられるのかが、大きな課題だ」と指摘する。
近年、in vitroモデルの技術革新は著しい進化を遂げた。細胞を単純にシャーレで培養するだけでなく、共培養、流路、オルガノイドなどのマイクロフィジオロジカルシステムを用いることで、創薬のブレイクスルーになると期待されている。
楠原教授は「今までは理想的な環境で採取した細胞を使えばよいと考えてきたが、今では、採ってきた細胞が元の性質や機能を発揮できるような環境を整える必要があり、その手法を開発することも重要な研究だと考えるようになった」と話す。
例えば楠原教授によると、市販されている一般的なヒト初代肝細胞はシャーレに接着しにくい、ロットごとに性質や機能が異なる、接着性を示す肝細胞は高価――などの問題点がある。
「細胞株の中には、ヒト肝細胞株HepaRG® のように比較的生体内での性質や機能を数多く受け継ぎ、継代培養が可能なため、長期にわたる実験に利用可能なものもあるが、例外である。引き続き、生体を模倣したin vitroモデルの開発が不可欠だ」
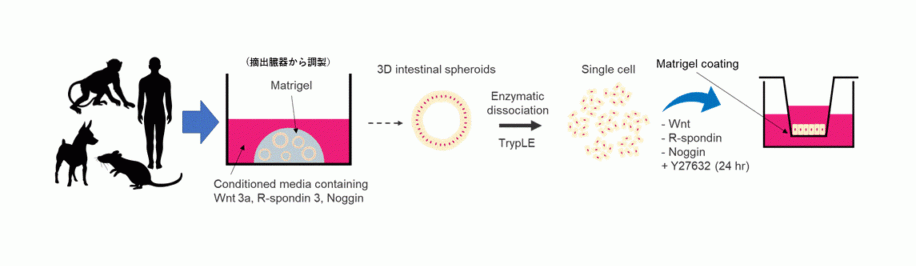
楠原教授はこう指摘し、取り組みの一例として、前田和哉博士(北里大学薬学部教授)と共同研究している「腸管クリプト由来幹細胞を利用した小腸モデルの樹立」を挙げる。
「こうした細胞株を、ヒトの脳細胞や腎臓などでも樹立し、最終的にはin vitroの実験だけで生体内の薬物動態がすべて予測できるようにすることを目指している。今は、薬物動態試験に用いる細胞は、どんな機能を備えていなければならないかを、解析しているところだ」
現在、楠原教授が力を注いでいるのが、これまでの研究成果を応用した薬物相互作用の予測手法開発だ。「医薬品の臨床試験において、薬物相互作用の検証試験は後半で実施される。もっと早い段階で、評価のための薬を投与しなくても評価できるように、薬物トランスポーターのバイオマーカーを探索する研究を進めている」と楠原教授。
すでに腎臓、肝臓で薬物トランスポーターのバイオマーカーとなる物質をいくつか見出し、トランスポーターの阻害薬を投与すると投与量に応じてバイオマーカーの量も変動することを報告している。
この研究成果を実用化することで、「従来の臨床試験では開発中の化合物と相互作用が懸念される薬を同時に投与していたが、第1相試験など開発中の化合物だけを投与する状況においても、薬物相互作用リスクが予測可能になるだろう。生理学的薬物速度論モデルを用いた解析と精密な薬物相互作用リスク予測に基づいて、薬物相互作用の重篤度を判断することができる」と楠原教授は期待を口にする。
楠原教授らの「新規薬効成分の薬物動態解析と体内動態特性予測」研究は、2022年度にAMEDの「生命科学・創薬等研究支援基盤プラットホーム事業(BINDS)」研究課題に採択され、その成果を創薬支援に生かす枠組みが整った。
楠原教授は「研究中の薬に薬物動態的な課題がある場合、あるいは薬物動態的な課題があるのかどうか知りたい場合には、気軽にお声掛けいただきたい」と話している。
過去の記事
-
新たに確立した神経変性疾患モデルラットを用いて病態メカニズムを解明

大阪公立大学大学院 獣医学研究科 准教授 田中美有氏 -
転写因子も創薬標的にできる新たなモダリティ「PROTAC」研究を推進

国立医薬品食品衛生研究所 有機化学部 部長 出水庸介氏 -
新しい理論「生物力学」とAIを活用した汎用疾患予測モデルを開発

慶応義塾大学医学部 教授 桜田一洋氏(石井・石橋記念講座/拡張知能医学) -
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏