研究・開発の窓 COLUMN
大脳での記憶形成・維持に関わる分子・細胞レベルの機構解明を推進
奥野浩行鹿児島大学教授
認知症や精神疾患の治療法・治療薬開発への応用に期待
 鹿児島大学大学院医歯学総合研究科奥野浩行教授(生体機能制御学講座 生化学・分子生物学分野)らのグループは、大脳での認知機能、特に記憶形成や維持に関わる分子・細胞機構や神経回路を解明することにより、認知症や精神疾患を始めとする高次脳機能障害に対する治療法開発への貢献を目指している。また、これらの神経機能を解析するための新しいツールや方法の開発にも尽力している。
鹿児島大学大学院医歯学総合研究科奥野浩行教授(生体機能制御学講座 生化学・分子生物学分野)らのグループは、大脳での認知機能、特に記憶形成や維持に関わる分子・細胞機構や神経回路を解明することにより、認知症や精神疾患を始めとする高次脳機能障害に対する治療法開発への貢献を目指している。また、これらの神経機能を解析するための新しいツールや方法の開発にも尽力している。
我々ヒトの行動は、脳の中に蓄えられた過去の出来事や経験を参考にして決定されるため、記憶のメカニズムを解明することは、行動・意思決定に関わる神経回路の理解などにもつながる。ひとくちに記憶といっても、例えば、レジでの支払い額を、財布からお金を出すまでの間だけ覚えている「短期記憶」、日々の生活での出来事などを数日~1カ月程度覚えている「長期記憶」、さらに、子供の頃の楽しかったイベントなどを生涯覚えている「永続的記憶」など、記憶は持続時間によって数種のクラスに分類される。
最近、これらの記憶は、その持続時間によってそれぞれ大脳の異なる場所が使われていることが明らかになってきた。すなわち、記憶獲得時に使われている神経回路が、時間とともに切り替わっているのである。さらに、この脳の神経回路の切り替わりに遺伝子発現が関わっていることが判ってきた。つまり、記憶を獲得する時には、その持続時間によって脳のいろいろな領域で神経細胞間での情報の受け渡し効率が変化する。その現象には、神経活動によって引き起こされる遺伝子発現が関わっているということだ。
奥野氏らの研究グループでは、この脳の遺伝子発現と長期記憶の形成を、マウスを用いて解明する基礎研究を推進している。
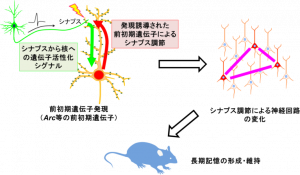
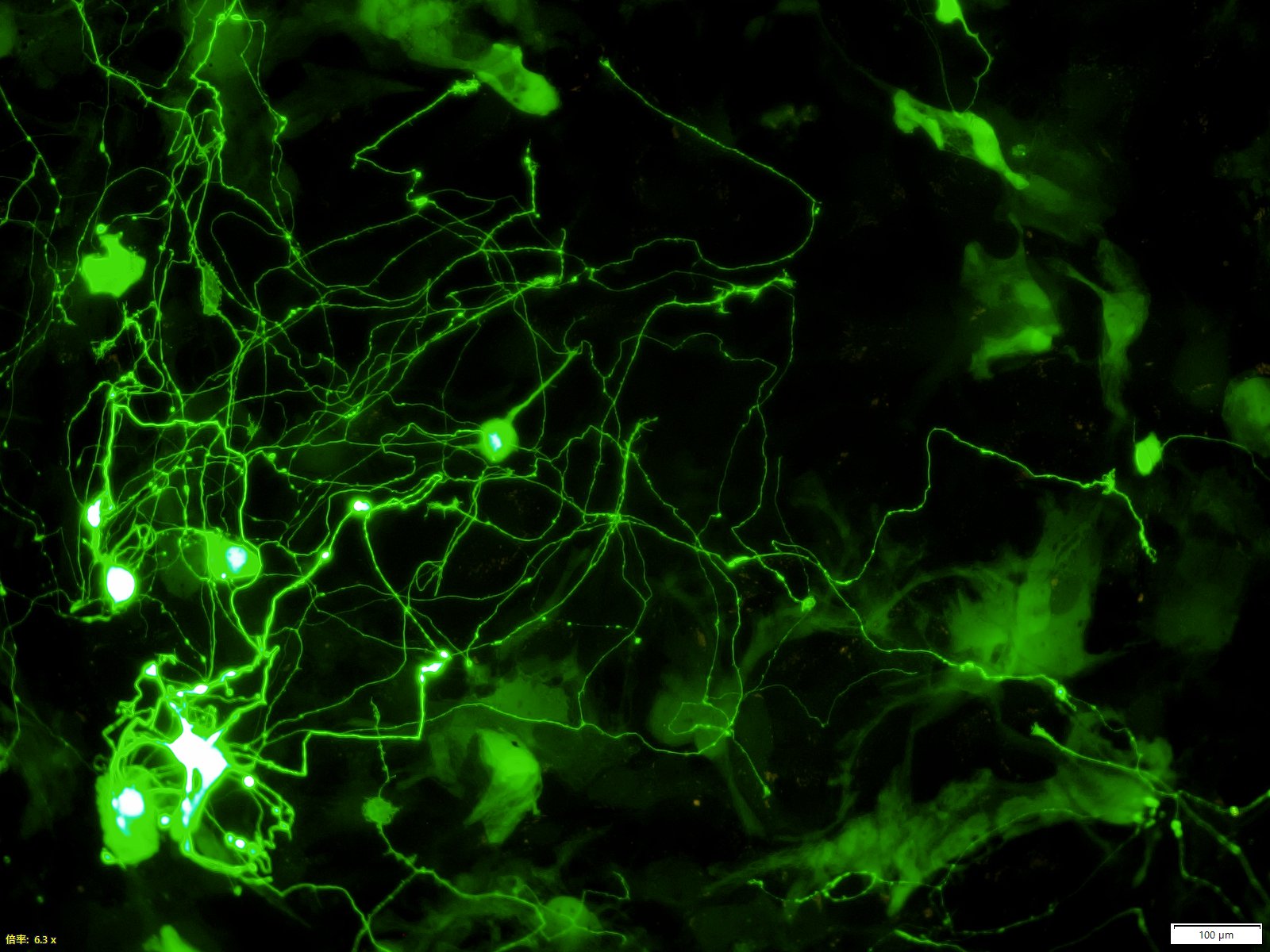
神経活動による遺伝子発現誘導では、まず、神経細胞が他の神経細胞から神経伝達物質を受け取ってシナプスが活性化され、シナプスから核に遺伝子活性化シグナルが送られる。送られてきたシグナルにより核の中で前初期遺伝子と呼ばれる遺伝子群が発現する。
この大脳で発現する代表的な前初期遺伝子としては、Arc遺伝子やc-fos遺伝子などが挙げられる。学習や経験によって脳が刺激されて発現誘導された前初期遺伝子がシナプス機能を調節することにより、神経回路の変化が起こり、長期記憶が形成維持される(図1)。
奥野氏らの研究グループは、前初期遺伝子の中でも、特に生理的な神経活動をよく反映するArc遺伝子に注目してきた。
Arc遺伝子を欠損したマウス(Arcノックアウトマウス)で恐怖条件付け課題などの記憶テストを行うと、記憶獲得後24時間後の記憶スコアは野生型のマウスに比べて低い。さらに、1か月後に記憶テストを行うとArc欠損マウスでは記憶スコアが著しく低かった。
これらの結果から、Arc遺伝子が無くなってしまえば長期記憶や永続的記憶ができなくなると考えられる。現在、研究グループではArc遺伝子が長期記憶および永続的記憶の形成・維持に“いつ”、“どこで”、“どのように”働いているのかの解明を推進している。
また、Arc遺伝子以外にも神経活動依存的に発現誘導される機能未知の遺伝子を多数同定しており、これらの遺伝子の機能についての解析を進めている。さらに、こうした神経活動依存的な遺伝子発現は、記憶だけではなく脳の発達や機能維持にも重要な役割をしていることもわかってきた。
近年のヒトの疾患ゲノム解析からは、神経活動依存的な遺伝子発現に関わるさまざまな遺伝子の変異が精神疾患や発達障害を惹起し易くなることが明らかになってきた。例えば、シナプス部で神経興奮に関わるCa2+チャネルの遺伝子異常や、シナプスから核へ伝わるシグナル分子に関連した遺伝子が欠損すると、自閉症を含む発達障害を引き起こす。
こうした疾患の解明にも大脳の遺伝子発現の機能を解析し理解することが重要である。
一方、実験手技・技術に関しては、いつも新しい方法にアンテナを張って良いものがあれば積極的に取り入れて研究を進めている。例えば、遺伝子改変マウスはこれまではES細胞を用いた従来法で作製していたが、近年ではGONAD法(Genome-editing via Oviductal Nucleic Acids Delivery)を用いて効率良く、遺伝子改変マウスを作製している。
佐藤正宏博士(鹿児島大学大学院・教授)と大塚正人博士(東海大学・教授)らの研究グループによって開発されたGONAD法は、卵管内の受精卵に対する電気穿孔分子導入を利用した画期的な遺伝子改変動物作製法である。
これまでの手法と比較して格段に迅速かつ簡便に遺伝子欠損や外来遺伝子導入を行うことが可能である。奥野氏らは佐藤教授と共同して(株)ケー・エー・シーの技術員等への技術講習会なども開催し、同法の普及に尽力している。
また、AAV(アデノ随伴ウイルス)ベクターを用いて外来遺伝子をマウスの脳のある領域だけに発現させたり、特定の遺伝子の機能を増減させたりする手法を常用している。
例えば、カルシウムセンサーの一種であるGCaMP6fをマウスの海馬CA1領域の神経細胞に発現させ、マウスの頭に乗せることができる超小型顕微鏡を使って自由行動下のマウスの脳神経の活性化状態(カルシウム応答など)をリアルタイムで観察している。
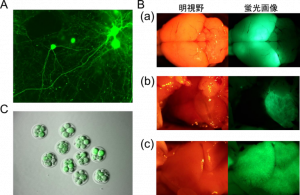
A, 培養培地投与による初代神経細胞におけるGFP発現
B, 静脈投与によるマウス大脳(a)、心臓(b)、および肝臓(c)でのGFP発現
C, 卵管投与によるマウス受精卵におけるGFP発現
AAVベクターは、病原性を持たない安全で実験し易いウイルスベクターで、神経科学分野では主要な遺伝子導入ツールとなっており、神経系だけでなく、筋肉や心臓、肝臓などの様々な臓器への遺伝子導入にも利用可能である(図2)。
これまでAAVベクターは、研究者自身で作製するか海外に発注するしかなかったが、最近では国内企業も受託作製((株)ケー・エー・シーも受託生産を開始)しており、AAVを用いた実験のハードルは格段に下がってきた。
現在、奥野氏らが進めている研究では、シナプスの形や数の制御に関与している遺伝子や樹状突起の複雑さ調節している遺伝子など、いくつかの新しい神経活動誘導遺伝子に注目し、前述した手法などを駆使して機能解析を行っている。
これまでの研究成果から「シナプスの数や長さ、大きさがきちんとコントロールされることが正常な認知機能には必要であり、その破綻は認知症や精神疾患などを引き起こす。だから遺伝子レベルでのシナプス機能調節の解明は重要だ」と強調する奥野氏。
「認知機能に関与する神経活動誘導遺伝子の働きが明らかになれば、それは創薬標的となりうる。製薬会社などとの共同研究を通じて治療薬開発に繋げていきたい」と抱負を述べる。
さらに、「アルツハイマー症の場合は、脳が委縮してしまった後に元の状態に戻すのは難しい。しかし、シナプス機能を補助することにより10年程度進行を遅らせることができれば、根本的な治療ができなくても健康寿命を全うすることができる可能性がある」と話す。
最後に、これからの研究を担う若手の研究者に向けては、「昨今、日本の研究力低下が懸念されている。様々な要因があると思うが、特に留学を希望しない若手研究者が増えてきたことも大きな一因だ」と指摘し、「研究の場を探す際には国内だけでなく海外にも目を向けてほしい。海外での経験は、将来、必ず生きてくる」と呼びかける。
今後の産学連携の重要性にも言及し、「大学の研究者だった者が、ある研究開発プロジェクトのために企業で働いた後再び大学での研究に戻ったり、反対に、企業の研究者が大学に移り、自由な発想で研究を行い一つの仕事を終えたらまた企業に戻るなど、産学間の流動性が高まれば日本の科学・技術はより向上するはずだ」と訴えかけた。
過去の記事
-
膜タンパク質の分解機構である「シェディング」が持つ生物学的意味を解明したい

立命館大学生命科学部教授・白壁恭子氏 -
肝がん、動脈硬化、認知症などの疾患とコンドロイチン硫酸合成異常の関連を解明

神戸薬科大学 学長・教授北川裕之氏(生化学研究室) -
製剤設計の効率化をめざし、製剤の特性をレオロジーで数値化する指標を提唱

静岡県立大学薬学部 近藤啓教授(創剤科学分野) -
シトクロムP450の研究で化学物質代謝の種差や発がんメカニズムを解明

昭和薬科大学 薬物動態学研究室 教授 山崎 浩史氏 -
小児の白血病を引き起こす分子メカニズムの解明から革新的創薬へ

国立がん研究センター 鶴岡連携研究拠点 チームリーダー 横山明彦氏