研究・開発の窓 COLUMN
革新的組換えウイルス作製技術やモデル動物を駆使してプラス鎖RNAウイルスの生態を研究
九州大学 大学院医学研究院 准教授 田村友和氏
あらゆるプラス鎖RNAウイルスの人工合成を数カ月から1週間に短縮
 ウイルスはその種類ごとに感染する生物(宿主)や組織が違い、病態も異なる。九州大学大学院医学研究院准教授の田村友和氏(ウイルス学分野)は、「ウイルスがどのように宿主特異性や組織指向性を獲得し、病原性を発現するのか」というウイルス学の根源的な命題に対し、獣医師というバックボーンを生かしながら研究を行っている。
ウイルスはその種類ごとに感染する生物(宿主)や組織が違い、病態も異なる。九州大学大学院医学研究院准教授の田村友和氏(ウイルス学分野)は、「ウイルスがどのように宿主特異性や組織指向性を獲得し、病原性を発現するのか」というウイルス学の根源的な命題に対し、獣医師というバックボーンを生かしながら研究を行っている。
田村氏が所属する九州大学 医学研究院のウイルス学分野(福原崇介教授)が主に研究対象としているのはプラス鎖RNAウイルスである。近年、世界で流行したSARS、デング熱、新型コロナウイルス感染症、C型肝炎のウイルス、さらには豚だけに発症する豚熱などの原因ウイルスもこのタイプであり、同研究室は①プラス鎖RNAウイルスを研究するための基盤技術開発、②病態発現の分子機構解明、③感染指向性を規定する因子の解明、④ワクチン開発など感染症の制御への貢献―を4本柱に研究を続けている。
田村氏は「今ではウイルスが単離できれば、すぐに遺伝子配列が決定され、データベースで変異も特定できる。しかし、どの変異が発症や重症化の決め手になるのかを解明するためには、リバースジェネティックス技術を用いて変異を持った遺伝子を人工合成し、モデル動物に外挿して評価する実験が欠かせない」と述べる。
同研究室が創り上げた革新的なリバースジェネティクスの基盤技術の一つが、「あらゆるプラス鎖RNAウイルスを迅速に人工合成する技術」である。従来、遺伝子組み換えウイルスを人工合成するには数カ月程度の時間を要していたが、田村氏は「特に時間を要するのがクローニングであり、クローニングした遺伝子を挿入したプラスミドを大腸菌内で培養する工程も複雑な操作が必要で時間が掛かる」と課題を指摘する。田村氏らは、クローニングを行わずにウイルスゲノムを複数の断片に分け、PCRで増殖させてから試験管内でウイルス遺伝子を再構築するCPER法を導入して改良を重ね、熟練した技術者がいなくても、どんなプラス鎖RNAウイルスでも、1週間程度で人工合成することを可能にした(図1)。
この方法を用いると、唾液などの臨床検体から直接、核酸を抽出してウイルスを人工合成できるため、頻繁に変異する新型コロナウイルスの分析などで大きな力を発揮したという。
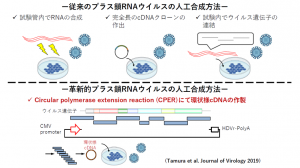
(イラストはBiorender.comで作成)
もう一つの基盤技術がプラス鎖RNAウイルスの感染モデル動物の開発である。例えば、新型コロナウイルスは野生型マウスには感染しないことが分かっていたため、田村氏らはヒトの免疫細胞と肺組織を免疫不全マウスに移植することにより、体内に新型コロナウイルスの標的組織を再構築したモデルマウスを開発し、新型コロナウイルスの感染による組織障害や免疫応答を解明してきた。
さらに、レポーター技術をプラス鎖RNAウイルス研究に取り入れるため、発光酵素を⼩さなペプチド断⽚に分割したスプリット型レポーターウイルスを創出した。従来技術で作製したレポーターを搭載したウイルスは増殖しにくいためにあまり利用されていなかったが、田村氏らが創出したレポーターウイルスは親株と同等の増殖性を有するため利用しやすく、対象ウイルスの感染を簡便に検出できるという。
獣医師として、特に田村氏が力を注いだのが、プラス鎖RNAウイルスの中でもフラビウイルス科に属するウイルス群である。類似した遺伝子構造を持つウイルスでありながら、あるものは偶蹄類のみに感染し、あるものは肝臓に高い指向性を持ち、あるものは節⾜動物(昆虫など)と哺乳類の間で感染環を形成する。
その一つである豚熱ウイルスはブタにしか感染せず、フラビウイルス科の中でも宿主特異性が非常に高い。田村氏は豚熱の弱毒生ワクチンGPE−を使用して、病原性の発現機序を解明する研究を行った。
GPE−ワクチンは、豚熱ウイルスに感染したブタから強毒株ウイルスを分離し、ブタ精巣細胞、ウシ精巣細胞およびモルモット腎臓細胞で継代培養し、馴化させて弱毒化したものである。この弱毒生ワクチンを本来の宿主であるブタに投与し、さらにそのブタから分離したウイルス株を次のブタに投与する実験を重ねると、11代継代した後には病原性を獲得した。
田村氏は「継代前のウイルスと継代後のウイルスの遺伝子塩基配列を比較すると、ウイルスの表⾯糖タンパク質E2に1カ所、⾮構造タンパク質NS4Bに2カ所のアミノ酸変異が認められた」と明かす。加えて、「それらの変異株をリバースジェネティクスで人工合成してブタに接種し、3カ所の変異が病原性発現に関与することを確認した」と説明する。
田村氏らはさらに研究を続け、それぞれの変異がウイルスの細胞への吸着と吸引、ウイルスゲノムの複製、宿主免疫の抑制に関与することを突き止めた(図2)。
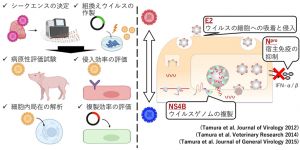
(イラストはBiorender.comで作成)
また、その後の研究でフラビウイルス科ではNS1、Ernsなどの分泌性膜結合タンパク質がウイルス粒子の産生に関与する共通のメカニズムがあることを明らかにした。
同研究室はこうした研究手法を応用し、新型コロナウイルスの変異株解析でも成果を収めた。例えば、オミクロンXBB.1とXBB1.5の違いは2つのアミノ酸置換だけであるが、リバースジェネティクス技術で人工合成した変異ウイルスと、新型コロナウイルス感染モデル動物を用いて、この2つの変異が病原性発現に大きな影響をもたらすことを示した。
田村氏はこれら一連の研究で文部科学大臣表彰「若手科学者賞」を受賞した。今後は「さらに研究を加速させ、将来的にはウイルスの遺伝子情報から宿主や感染組織、重症化リスクなどを予測できるようにしたい」と目標を語る。
デング熱の重症化を解析できるモデル動物の開発研究を推進
田村氏は「デング熱の重症化を解析する動物モデルの開発」で2023年にケー・エー・シー創立45周年記念研究助成に採択され、当該研究を推進中である。デング熱はデングウイルスによる蚊媒介性の感染症で、全世界で1億人が感染するとされるが、ワクチンは一部の流行国での使用にとどまっている。
2014年には国内でも発生し、代々木公園が閉鎖されるなどの事態につながった。2019年には奈良・京都を修学旅行した生徒の感染が確認され、輸入感染だけでなく、土着感染である可能性も疑われている。
「デングウイルスは4つの血清型がある。1度目の感染では発熱程度と比較的軽症だが、2度目に別の血清型のデングウイルスに感染するとデング出血熱という重症病態を惹起することが知られているが、詳しくは分かっていない」と話す田村氏。さらに、「野生型マウスには感染せず、免疫不全マウスは感染するとすぐに死亡するため十分な病態解析ができないからだ」と指摘する。
こうした状況を踏まえ、田村氏は米国留学時代に、ヒトのCD34+造血幹細胞をマウスに導入したヒト化免疫マウスを作製・改良してデングウイルスの感染動態研究を行い、「免疫応答の上昇や血小板数減少などの重症デング熱と同じ動態が認められたため、デング熱モデルマウスとして有用なことを論文発表した」という。
ただ、均質なヒトCD34+造血幹細胞を十分量採取できる胎児造血臓器は日本では入手が困難という課題があるため、「ケー・エー・シー研究助成を受けられたことを機に、新たな動物モデルを開発する研究を進めている」と明言。その上で、「デング熱ワクチンは4つ血清の全てに対する混合ワクチンとなるが、これらウイルスのバランスが重要だと考えられる。有用で安定的に供給できるモデル動物を開発することで、デング熱の病態解明とワクチンの評価に貢献できるだろう」と語る。
過去の記事
-
薬物の代謝速度や相互作用に関与する小胞体膜トランスポーターの機能を解明する

名古屋市立大学大学院 薬学研究科 教授
荒川大氏 -
消化管全体の生理環境と薬物動態を考慮した革新的な薬物吸収性予測モデルを開発する

昭和薬科大学 薬学部 教授 白坂善之氏
(薬剤学研究室) -
プロテオーム解析を起点に老化関連疾患の病態機序や健康長寿の因子を探索

東京都健康長寿医療センター研究所 研究部長 三浦ゆり氏(老化機構研究チーム プロテオーム研究) -
バイオ医薬品の経口投与や効率的脳内移行を実現する「組織関門透過ペプチド」を発見

熊本大学大学院 生命科学研究部 准教授
伊藤慎悟氏 -
食品の機能性成分を分子・細胞レベルで解析し、「食による病気の予防」を目指す

群馬大学大学院 食健康科学研究科・理工学府 教授 薩秀夫氏




