研究・開発の窓 COLUMN
抗体薬物複合体の生体膜透過メカニズムを解明し、医薬品の体内動態の最適化を目指す
東京薬科大学薬学部 井上勝央教授(薬物動態制御学教室)
 近年、抗体やRNAなど新しい創薬モダリティを用いた医薬品の開発が急増しているが、東京薬科大学薬学部教授の井上勝央氏(薬物動態制御学教室)らは、これらの医薬品の細胞内への取り込み(生体膜透過)を中心に研究を重ねている。
近年、抗体やRNAなど新しい創薬モダリティを用いた医薬品の開発が急増しているが、東京薬科大学薬学部教授の井上勝央氏(薬物動態制御学教室)らは、これらの医薬品の細胞内への取り込み(生体膜透過)を中心に研究を重ねている。
井上氏は「創薬では薬効のある医薬品を世に出すことが優先されるため、ニューモダリティを用いた医薬品の体内動態の解明や最適化は一歩も二歩も遅れている」と指摘し、「それらを解明し、制御する方法を開発することにより、より有効で副作用の少ない医薬品開発や臨床での薬物相互作用回避につなげることができる」と強調する。
薬物が生体膜を通過するルートには、主に、脂溶性物質が脂質二重膜を透過するルートと水溶性物質が各種トランスポーターを介して通過するルートの2つがあり、分子量が小さく、脂溶性が高く、水素結合性が低い物質は生体膜透過性が高い。
「抗体医薬やサイトカインなどの高分子で親水性が高い医薬品は標的細胞の選択性は高いが膜透過性が低く、経口投与は難しい。そこで現在、分子量1000~10,000程度の中分子創薬に期待が寄せられている」と井上氏は最近の創薬トレンドを示すとともに、「当教室では中分子創薬のモダリティである環状分子、ペプチド、ADC(抗体薬物複合体)などの生体膜透過に関わる研究を展開している」と続ける(図1)。
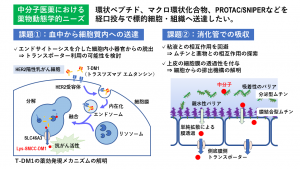
代表的な研究の一つは、ADCの生体膜透過メカニズムの研究である。ADCは抗体と殺細胞性成分をリンカーで結合した構造であるが、抗体が標的細胞の抗原に結合した際、リンカーが切断されて低分子の殺細胞性成分が標的細胞を含めた周辺の細胞に作用するタイプ(切断型)と、切断されずに標的細胞のみに取り込まれて作用するタイプ(非切断型)に分かれる。がん細胞のみを攻撃する特異性は非切断型が高いが、現状では切断型の方が多く世に出ている。
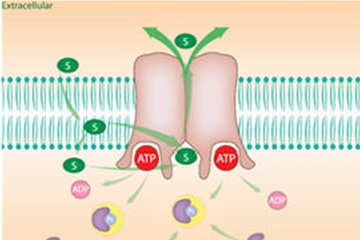
「ADCの細胞内動態は、細胞外にある物質を小胞に包み込んで細胞内に取り込むエンドサイトーシス現象によって取り込まれたADCが、細胞内小器官であるリソソームに移行して分解され、リソソームから殺細胞成分が細胞質内に放出されて薬効を発揮すると説明されてきた。リソソームにも生体膜があるため膜透過するメカニズムがあるはずだが、そこに着目した研究はほとんどなされていなかった」と井上氏は指摘する。
リソソームは細胞にとって不要な物質を溜めて分解して廃棄するゴミ箱のような役割を果たしているが、「これまで、医薬品のような物質を細胞質からリソソームに取り込むトランスポーターはいくつか知られていたが、リソソームから細胞質に医薬品成分を排出するトランスポーターは同定されていなかった」と井上氏。
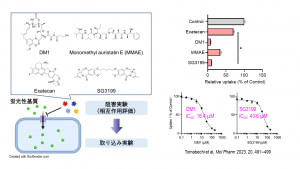
トラスツズマブ エムタンシン(T-DM1)はHER2抗体トラスツズマブに微小管重合阻害薬のエムタンシンを結合させた非切断型ADCであるが、同薬の薬効発現にはリソソーム膜上のタンパク質SLC46A3が関与することが網羅的遺伝子探索から報告されていた。井上氏らは、SLC46A3がリソソームからエムタンシン分子を細胞質内に輸送する役割を果たすトランスポーターであるとの仮説を立て、観察が可能な細胞膜上にSLC46A3を移行発現させてエムタンシン分子を輸送するかどうかの実験を重ね、その機能を確認した。
また、乳がん細胞株にT-DM1とトランスポーターSLC46A3の阻害剤を同時に添加すると、細胞内にT-DM1が移行しているにもかかわらず細胞死に至る率は低下した。阻害剤として用いたのは数種のマクロライド系抗菌薬で、薬剤の種類によって、T-DM1の薬効減弱には差があることも示された。
これらのことから井上氏は「T-DM1は細胞内のリソソームで分解され、SLC46A3を介してエムタンシン分子を細胞質に直接輸送することで薬効を発揮することが明らかになった」と結論付けるともに、「われわれはSLC46A3の基質となる蛍光物質を特定してアッセイ系を構築し、さまざまな化合物の評価実験を進めている。細胞内でより有効に機能する殺細胞成分を用いたADCを開発することや、臨床ではADCと相互作用のある薬剤の併用を避けることが可能になると考えている(図2)。
また、SLC46A3以外のリソソーム膜トランスポーターの探索研究も行い、ADCの最適化に貢献していきたい」と話している。
経口中分子医薬品開発の鍵はムチンと側底膜トランスポーター
2つ目の研究は、経口中分子創薬を目指す腸管粘液層のムチン分子研究である。腸管上皮細胞にある粘液層を形成する糖タンパク質ムチンは生体外からの異物侵入を防ぐバリアとして働いているが、「低分子医薬品とムチンとの相互作用は限定的であることは経験的にわかっているが、中分子医薬品と相互作用するかどうかはほとんど研究されていない。おそらく中分子医薬品ではムチンの透過性が問題になると推測し、研究をスタートした」と井上氏。
市販されている腸管細胞株ではムチンを分泌する機能がほとんど失われているため、同教室ではムチンを遺伝子クローニングして細胞表面に人工的に強制発現させ、薬物の透過性を調べる実験を行っている。例えば、「抗がん薬の中では分子量が小さい5-FUはムチンの影響を受けにくいが、分子量が大きいパクリタキセルはムチンがあると透過性が大きく低下することがわかった。」という。
また、中分子創薬のモダリティとして最も期待を集めている環状ペプチドもムチン分子と相互作用があることが示されつつあるという。
3つ目の研究は、小腸上皮側底膜における薬物排出機構の解明と中分子創薬への応用だ。従来から小腸上皮細胞にはさまざまなトランスポーターが発現することがわかっていたが、それらのほとんどは消化管腔に接する頂端膜側に発現するもので、血管に接する側底膜側に発現するトランスポーターはほとんど見つかっていない。特に薬物の吸収に関与する十二指腸や空腸上部の上皮細胞でのトランスポーターは不明とされているが、低分子医薬品が小腸上皮細胞から吸収されて血管に移行する事実から、側底膜側にもトランスポーターが存在すると考えられる。
井上氏らは「MCT6が小腸上皮側底膜トランスポーターの候補分子である」と主張している。MCT6はモノカルボン酸トランスポーター(MCT)ファミリーのメンバーで消化管に発現することは示されていたが、薬物吸収に関わるトランスポーターとは認識されていなかった。
そこで、MCT1、2、4分子がCD147という補助タンパク質と相互作用して複合体を形成することに着目し、MCT6も同じではないかと考え、MCT6タンパク質の安定性や細胞内局在について解析。MCT6は単独では細胞膜にはほとんど発現しないが、CD147と同時に発現させると複合体を形成して細胞膜に局在化することを見出した。
さらに、MCT6とさまざまな医薬品との相互作用を確認すると、有機アニオン性医薬品と強く相互作用することが示された。
井上氏は今後の研究課題に関して「MCT6は中分子の透過が期待できると考えている。管腔内から小腸上皮細胞内への移行は、添加剤などを用いた製剤学的手法により促進できるものと期待されるが、細胞内から血管への薬物移行ではそのような手法を用いることはできないため、中分子医薬品の経口投与実現には小腸上皮側底膜トランスポーターの機構を生かす研究が重要なポイントになるだろう」と述べる。
また、エンドサイトーシスを介した薬物の細胞内への取り込み機構が注目されている。井上氏は「エンドサイトーシスで細胞内、リソソーム内に取り込める薬物の量は少ないが、近年は少量で高い効果を示す薬物が創製できるようになり、確実に標的に入れる方法が重視されるようになったからだ」と理由を述べるとともに「今後は細胞内小胞やリソソームなどに取り込まれた薬物を効率的に細胞質に排出する方法が重視されるようになるだろう」と話している。
過去の記事
-
新たに確立した神経変性疾患モデルラットを用いて病態メカニズムを解明

大阪公立大学大学院 獣医学研究科 准教授 田中美有氏 -
転写因子も創薬標的にできる新たなモダリティ「PROTAC」研究を推進

国立医薬品食品衛生研究所 有機化学部 部長 出水庸介氏 -
新しい理論「生物力学」とAIを活用した汎用疾患予測モデルを開発

慶応義塾大学医学部 教授 桜田一洋氏(石井・石橋記念講座/拡張知能医学) -
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏