研究・開発の窓 COLUMN
化学物質による毒性研究を発展させ、実用的な動物実験代替法の確立を目指す
静岡県立大学 薬学部 吉成浩一教授(衛生分子毒性学分野)
 動物愛護の観点から動物実験の削減や適正化が推進され、従来、そのほとんどが動物実験で行われていた毒性試験の分野でも代替法の確立が急務となっている。静岡県立大学薬学部の吉成浩一教授(衛生分子毒性学分野)は、それまで培ってきた核内受容体を介した化学物質の発がん機序とその種差の研究を踏まえ、化学物質の安全性評価における動物実験代替法の開発に取り組む研究者だ。
動物愛護の観点から動物実験の削減や適正化が推進され、従来、そのほとんどが動物実験で行われていた毒性試験の分野でも代替法の確立が急務となっている。静岡県立大学薬学部の吉成浩一教授(衛生分子毒性学分野)は、それまで培ってきた核内受容体を介した化学物質の発がん機序とその種差の研究を踏まえ、化学物質の安全性評価における動物実験代替法の開発に取り組む研究者だ。
吉成氏の研究室では、医薬品、化粧品、農薬など化学物質の有害作用、ヒトを含む哺乳動物の化学物質応答性の研究をメインテーマとしている。吉成氏自身は長年、細胞の化学物質センサーとして働く核内受容体の研究に取り組んできた。
核内受容体はリガンドである低分子化合物と結合することにより、種々の遺伝子の発現を調節し、細胞の機能を制御する。中でも吉成氏が着目したのが核内受容体の一つ、CAR(constitutive androstane receptor)である。
「私は大学時代に薬物代謝酵素に関する研究を行っていたが、薬物の曝露により薬物代謝酵素が増える酵素誘導と呼ばれる現象は、古くから知られていたにもかかわらず、その機序は解明されていなかった。1998年に相次いでPXRとCARという核内受容体が医薬品に応答して薬物代謝酵素の遺伝子発現を促すことが報告されたが、その年にCARによる酵素誘導を発見した米国・国立環境健康科学研究所(NIEHS)の根岸博士の研究室に留学し、CARに着目した研究を行うようになった」と吉成氏はその経緯を説明する。
代表的なCAR活性化薬に、抗てんかん薬のフェノバルビタールがある。フェノバルビタールはCYP3A4を誘導し、さまざまな薬物と相互作用を引き起こすことが知られている。一方で、フェノバルビタールはげっ歯類において肝がんのプロモーターであることも知られていた。だが、抗てんかん薬としての長年の使用経験から、ヒトでの発がん性はほとんど問題にならない、すなわち種差があることも分かっていた。
核内受容体CARを介した肝発がん機序と種差を解明
2004年に吉成氏が留学していたNIEHSの研究室からフェノバルビタールによる肝発がんにはCARが必要であることが報告された。だが、この時点ではその機序までは解明されていなかった。そこで、吉成氏はCARを介した肝発がんの機序とその種差について、深く研究を進めていった。
吉成氏は「CARのリガンドとなる化学物質は多い。CARを介した発がん機序と種差を解明することにより、ラットを用いた発がん性試験で肝がんが生じたとしても、それがCARを介する作用であると分かれば、ヒトへの外挿性は低いと考えられ、機序、種差の理解はレギュラトリーサイエンスに応用できる」とその狙いを語る。例えば、多くの農薬はラット発がん性試験で、非遺伝性毒性による肝がんを生じるが、吉成氏は「そのほとんどがCARを介した発がんであることが分かった。動物実験の結果をヒトに外挿できるかどうかの判断に有用な科学的根拠となるだろう」と話す。
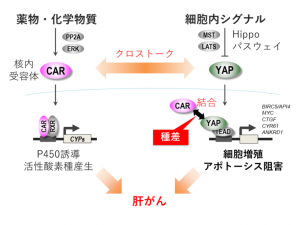
CARを介した発がんがどのように生じ、なぜ種差が生じるのか。吉成氏は、CARの活性化が細胞や臓器の大きさの制御や腫瘍形成に関わる細胞内シグナル伝達経路であるHippoパスウェイにも影響を与えているという仮説を立てた。フェノバルビタールなどの酵素誘導物質をげっ歯類に投与すると、肝臓が肥大するという現象が知られていたからだ。
正常なHippoパスウェイが働いていると、細胞増殖につながる転写共役因子のYAPは細胞質で分解され、核内にはあまり移行しない。だが、げっ歯類にCAR活性化薬を投与すると、核内に移行するYAPが増えてその標的遺伝子の発現が亢進し、細胞増殖やアポトーシス抑制が生じることを、吉成氏は明らかにした(図1)。
さらに、「マウスのYAPとCARは直接結合するが、CARのアミノ酸配列には種差があり、ヒトのCARはYAPと結合する配列が失われていることが分かった」と吉成氏。CARのYAP結合配列をヒト型に変異させたCARヒト型化マウスでは、YAPとCARの結合が見られず、細胞増殖が著しく減弱することも分かった。現在は、ヒト型CARを持つ動物では肝発がんが起こらないことを証明する研究に取り組んでいるところだ。
リードアクロス法による動物実験代替法を開発中
吉成氏がもう一方で注力する研究が、こうした発がん機序の研究成果も反映した動物実験代替法の開発である。先行するEUでは2004年から化粧品の動物実験規制が開始され、2013年には動物実験が行われた化粧品、原料および配合原料は全て販売禁止となった。今年成立した米国のFDA近代化法でも前臨床での動物実験義務付けが廃止されるなど、動物実験削減の流れは医薬品にまで広がり、世界的に加速しつつある。
ただ、吉成氏は「局所的な皮膚刺激性試験などでは動物実験代替法の開発が進んでいるが、全身毒性を評価する反復投与毒性試験、発がん性試験、発達神経毒性試験などでは代替法開発が全く進んでいない」と指摘する。
AIや機械学習を活用する方法も考えられるが、毒性領域で公表されている動物実験データは少なく、精度高い予測モデルを構築するために必要なビッグデータの入手が困難という問題がある。動物実験が禁止の方向に向かう中、インビボ毒性試験ビッグデータの構築はますます難しくなると予想される。
吉成氏は「こうした状況の中、EUの化学物質規制において実用的な動物実験代替法と注目されているのが、リードアクロスによる安全性評価法だ」と話す。化学構造や生物学的特徴が類似した化学物質群をグルーピングし、評価対象となる被験物質と同じグループに属する評価済みの既知物質の毒性試験結果から、被験物質の毒性を類推(リードアクロス)する手法である。インシリコ的な手法であるが、比較的少ないデータ量で結果を推測することができる。
だが、吉成氏はリードアクロスによる評価手法には類似物質選択の段階で、①類似性の判断は人が主観的に行うため、再現性に問題がある、②全身毒性では毒性機序が不明な場合が多く、生物類似性の判断にどのような実験データを用いるべきか不明瞭――という課題があると指摘する。類似性の判断でまず用いられるのは化学構造であるが、どこまで類似していると同じグループと判断するのかという基準は明確ではない。ちょっとした官能基の違いで薬効や毒性が大きく異なる例はよく知られている。また、類似物質の毒性評価を外挿する段階でもいくつかの課題がある(図2)。
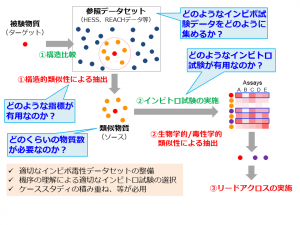
そこで、「化学構造とともに生物学的な特徴の類似性、特に毒性発現機序に関連する情報をその判断に活用すべき」と吉成氏は主張し、「例えば、CARを活性化するか否かも、肝発がん性を評価する上で有用な生物学的な特徴であるといえる。既存の知見や実際に得た実験データをもとに反復投与毒性や発がん性と関連するインビトロ試験を同定し、それらのさまざまな生物学的特徴で化学物質をグルーピングして毒性を評価するリードアクロス手法を確立すべく、研究を続けている」と続ける。
研究はまだ途上にあるが、反復投与毒性試験における肝毒性や血液毒性では、化学構造だけでグルーピングした場合の毒性予測精度は6割程度であるが、化学構造以外の特徴、例えば特定の薬物代謝酵素への反応性などを加えて予測するとその精度が向上する物質群があることが分かってきた。発がん性の予測では、機序関連試験の利用がより有益であることも示されつつある。
吉成氏は「化学構造情報に加えて、機序に関係する適切なインビトロ試験の結果を加えることで、リードアクロスによる安全性評価の精度は上がってくるだろう。国内のアカデミアで動物実験代替法の開発に取り組んでいる研究者は非常に少ない。日本のレギュラトリーサイエンスに貢献できるようさらに研究を加速したい」と話している。
過去の記事
-
新たに確立した神経変性疾患モデルラットを用いて病態メカニズムを解明

大阪公立大学大学院 獣医学研究科 准教授 田中美有氏 -
転写因子も創薬標的にできる新たなモダリティ「PROTAC」研究を推進

国立医薬品食品衛生研究所 有機化学部 部長 出水庸介氏 -
新しい理論「生物力学」とAIを活用した汎用疾患予測モデルを開発

慶応義塾大学医学部 教授 桜田一洋氏(石井・石橋記念講座/拡張知能医学) -
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏




