研究・開発の窓 COLUMN
がんや自己免疫疾患の発症にも関わる「直鎖状ユビキチン鎖」を発見
京都大学大学院医学研究科 岩井一宏教授(細胞機能制御学分野)
 ユビキチンは、タンパク質の翻訳後修飾系の一つであるが、多くの人はタンパク質の分解に関わるユビキチン―プロテアソームシステムを想起することだろう。だが、現在では、ユビキチン修飾系はタンパク質の分解のみならず、さまざまな生体機能の制御系として機能していることが分かってきている。京都大学大学院医学研究科の岩井一宏教授(細胞機能制御学分野)らが発見した、特異な構造のユビキチン「直鎖状ユビキチン鎖」は、がんや自己免疫疾患の発症にも関与することが示され、臨床医学や創薬の研究者からも熱い視線を浴びている。
ユビキチンは、タンパク質の翻訳後修飾系の一つであるが、多くの人はタンパク質の分解に関わるユビキチン―プロテアソームシステムを想起することだろう。だが、現在では、ユビキチン修飾系はタンパク質の分解のみならず、さまざまな生体機能の制御系として機能していることが分かってきている。京都大学大学院医学研究科の岩井一宏教授(細胞機能制御学分野)らが発見した、特異な構造のユビキチン「直鎖状ユビキチン鎖」は、がんや自己免疫疾患の発症にも関与することが示され、臨床医学や創薬の研究者からも熱い視線を浴びている。
岩井教授はもともとリウマチ・膠原病の臨床医であり、ユビキチン修飾系の研究にたどり着くまでには紆余曲折があったという。
「臨床医から研究者に転身したのは、研究者であった前妻と一緒に研究者としての人生を歩もうと決心したからだった。そして、一緒に米国留学を決めたが、その研究室は免疫学の研究で顕著な業績を上げていたが、生化学・細胞生物学分野で多彩な研究を展開しており、上司から鉄代謝調節機構の研究を命じられた」と岩井教授。
だが、鉄代謝調節機構の研究を進めるうちに、そこにはタンパク質分解系が関与していることが分かってきた。1990年代はタンパク質分解系の研究が脚光を浴び始めた時期である。タンパク質分解系に興味を持った岩井教授は、同僚の研究者の紹介で、後にユビキチン依存性タンパク質分解系の発見でノーベル化学賞(2004年)を受賞するアーロン・チカノーバー博士と出会い、親しく交わるようになったことから、ユビキチン修飾系の研究に軸足を移していった。
岩井教授は「タンパク質が生体の中でさまざまな機能を果たすことができるのは、多様な形、大きさのタンパク質が作られているからだ。しかし、タンパク質が存在しているだけでは機能が発揮されるとは限らず、ある状況においてのみ機能するタンパク質も数多い」として、次のような例を挙げる。
例えば、生体内に細菌が侵入すると、白血球は5~10分ほどで細菌を捕捉し、貪食する。細菌という刺激を受けてから、それを捕捉するタンパク質を合成するとなると、タンパク質の生成は10分では完了しないのでもっと長い時間が必要になる。
既存のタンパク質の機能を変えることにより、白血球は5~10分という短い時間で細菌を捕捉する機能を獲得できたわけである。細胞は状況に応じてタンパク質の機能を変化させることで、状況変化に対応する。これがタンパク質の翻訳後修飾による機能調節である。
ユビキチン修飾による機能の中で、最も早く見つかったユビキチン―プロテアソームシステムは、タンパク質にK48鎖というタイプのユビキチン鎖(複数のユビキチンが連結したもの)が結合すると、タンパク質分解酵素複合体であるプロテアソームによって分解されるというものだが、「ユビキチン鎖にはさまざまなタイプがあり、別のタイプのユビキチン鎖が付くとタンパク質は分解されず、違った機能を発揮する。例えばK63鎖はDNA修復、シグナル伝達などの機能を持つ」と岩井教授は説明する。
真核細胞を持つすべての生物は、7タイプの共通するユビキチン鎖を持つ。それらはユビキチン分子の中に存在する7個のリシン(アミノ酸略号=K)残基のいずれかに、別のユビキチンがC末端を介して結合していくことで、鎖状のポリユビキチンとなったものである。それぞれの結合部のリシンの配列順により、K+番号+鎖と表されている。
岩井教授らは、これらのユビキチン鎖とは全く異なる形状のユビキチン鎖と、それを生成する酵素複合体を発見した。それが直鎖状ユビキチン鎖とLUBAC(Liner Ubiquitin Chain Assembly Complex)ユビキチンリガーゼである。
新発見につながったのは、「ユビキチン鎖の生成過程に対する素朴な疑問だった」と岩井教授は振り返る。ユビキチン鎖はE1、E2、E3という3種類の酵素の連続的反応の繰り返しによって生成される。その最終過程では、E3に標的タンパク質が結合し、標的タンパク質のリジン残基にE2と結合していたユビキチンが転移し、さらにその先にユビキチンが次々に結合して伸びていくと考えられていた。だが、そうだとするとE3とユビキチンが反応する位置が次々と変化し、E3の活性中心からどんどん離れていくことになる。
「通常の酵素反応ではそんなことはあり得ない」と疑問を持った岩井教授は、E3がタンパク質を修飾しているユビキチンを標的として認識して、それにユビキチンを転移していけば、ユビキチンが次々に結合してユビキチン鎖が伸びていくことで、反応位置が動くことなくユビキチン鎖を生成するメカニズムがあるのではないかという仮説を立てた。
それを確かめる研究を進めるうちに、既存の7個のリシン残基以外の場所に結合して形成されるユビキチン鎖があることを発見し、「直鎖状ユビキチン鎖」と名付けた。直鎖状ユビキチン鎖は、リシン残基ではなくN末端のメチオニン(アミノ酸略号=M)残基に、別のユビキチンがC末端を介して結合するため、まっすぐ一直線にユビキチンが連なった形状をしている。
そのためM1鎖とも呼ばれる。また、E3の中でもLUBAC(Liner Ubiquitin Chain Assembly Complex)ユビキチンリガーゼと名付けた酵素複合体が、直鎖状ユビキチン鎖を生成していることも明らかにした。
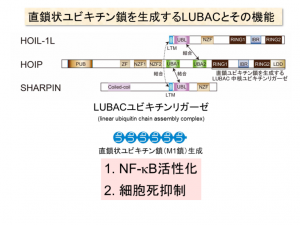
現在までに見つかっているユビキチン鎖の中で、メチオニン基を介して結合するのは直鎖状ユビキチン鎖だけであり、岩井教授らが見つけたLUBACユビキチンリガーゼ以外に直鎖状ユビキチン鎖を生成できる酵素は見つかっていない。
「また、興味深いことに、従来のユビキチン鎖はすべての真核細胞生物にあるが、直鎖状ユビキチン鎖は動物にしかなく、進化の過程で生まれてきたものと考えられる」という。
さらに、岩井教授らは直鎖状ユビキチン鎖修飾の機能解明を進め、次のような機能を明らかにした。
①免疫反応において中心的役割を果たす転写因子であるNF-κBの活性化
②プログラム細胞死の抑制
これが、疾患とどのような関係を示すかについても動物実験などで検証を重ねている。LUBACユビキチンリガーゼはHOIL-1L、HOIP、SHARPINという3つのサブユニットからなるが、そのうちの一つ、SHARPINを欠失したマウスは全身性の皮膚炎をはじめとする免疫不全症と自己炎症性症候群の症状を引き起こした。
岩井教授は、「SHARPINをノックアウトするとHOIL-1L、HOIPも極端に減少し、直鎖状ユビキチン鎖をほとんど生成できなくなった。直鎖状ユビキチン鎖の減少が自己炎症性疾患や免疫不全の発症につながることが確かめられた」と説明するともに、その後の研究から「逆にLUBACユビキチンリガーゼが活性化して直鎖状ユビキチン鎖が増えると、がんや自己免疫疾患の発症につながることも実験で分かってきている」と述べる。

臨床医学の研究者から「遺伝子変異が病気の原因であることはほぼ間違いないが、なぜ、そうなるのか理由がわからなかった。LUBACによる直鎖状ユビキチン鎖修飾系で理由が説明できないだろうか」といった問い合わせも増え、HOIL-1L遺伝子変異型の自己炎症性症候群、HOIP遺伝子変異型B細胞リンパ腫などで共同研究も開始された。
さらに、「例えば、LUBACを不活性化させるとPD-1免疫療法の感受性が上がることも動物実験レベルでは示唆されている。直鎖状ユビキチン鎖修飾による細胞死抑制が効かなくなり、細胞死が亢進するのではないかと考えられる」と岩井教授は述べ、LUBACを標的とした創薬の可能性も追求し始めているという。
岩井教授は若い研究者に向けて、「チカノーバ―博士は、わざわざエネルギーを使ってタンパク質を分解する系があるのに疑問を感じてユビキチン依存性タンパク分解系を発見した。われわれもまた、ユビキチン鎖生成に対する素朴な疑問から直鎖状ユビキチン鎖を発見した。若い研究者にもScientificな疑問に正面から向き合ってほしい」と話している。
過去の記事
-
新たに確立した神経変性疾患モデルラットを用いて病態メカニズムを解明

大阪公立大学大学院 獣医学研究科 准教授 田中美有氏 -
転写因子も創薬標的にできる新たなモダリティ「PROTAC」研究を推進

国立医薬品食品衛生研究所 有機化学部 部長 出水庸介氏 -
新しい理論「生物力学」とAIを活用した汎用疾患予測モデルを開発

慶応義塾大学医学部 教授 桜田一洋氏(石井・石橋記念講座/拡張知能医学) -
最先端のプロテオーム解析技術を用いて、進行胃がんの新たな治療標的を同定

国立研究開発法人 医薬基盤・健康・栄養研究所 創薬デザイン研究センター 副センター長 足立 淳氏(創薬標的プロテオミクスプロジェクト) -
研究機関の培養細胞の4分の1が

マイコプラズマに感染、定期的な検査が必須
医薬基盤・健康・栄養研究所 創薬資源研究支援センター長 小原有弘氏