研究・開発の窓 COLUMN
プロテオーム解析を起点に老化関連疾患の病態機序や健康長寿の因子を探索
東京都健康長寿医療センター研究所 研究部長 三浦ゆり氏(老化機構研究チーム プロテオーム研究)
加齢性中膜変性症の分子メカニズムを解明
 東京都健康長寿医療センター研究所・老化機構研究チームのプロテオーム研究テーマは、プロテオーム解析の手法を用いて老化関連疾患や健康長寿に関連するタンパク質の探索的研究を行うことだ。研究部長の三浦ゆり氏は、いわゆるオミクス研究と称される生体分子の網羅的研究に共通する特長として、「既存の仮説に囚われることなく新しい研究ができる」「生命現象の全体を把握することができる」の2点を挙げ、「作業仮説を立てられない場合や間違っていると思われる場合、バイオマーカーを探索したい場合に有用である」と説明する。
東京都健康長寿医療センター研究所・老化機構研究チームのプロテオーム研究テーマは、プロテオーム解析の手法を用いて老化関連疾患や健康長寿に関連するタンパク質の探索的研究を行うことだ。研究部長の三浦ゆり氏は、いわゆるオミクス研究と称される生体分子の網羅的研究に共通する特長として、「既存の仮説に囚われることなく新しい研究ができる」「生命現象の全体を把握することができる」の2点を挙げ、「作業仮説を立てられない場合や間違っていると思われる場合、バイオマーカーを探索したい場合に有用である」と説明する。
三浦氏らがプロテオーム解析で研究した老化関連疾患の一つは、動脈硬化症の一種である加齢性中膜変性症である。動脈硬化症は病理学的には粥状硬化症(アテローム性動脈硬化)と加齢性中膜変性症に分類されるが、後者の研究はあまり進んでいない。
「血管の平滑筋細胞を染色すると、若齢に比べて高齢で細胞の減少、変形や石灰化が起きていることが昔から知られていたが、その分子メカニズムは不明だった。そこで私たちは、若齢群、中齢群、高齢群のヒト大動脈中膜検体を用いてプロテオーム解析を行い、含まれるタンパク質を網羅的に解析し、高齢群で発現変化したタンパク質を調べる研究を行った」と三浦氏。その結果、246のタンパク質が同定され、高齢群で増加したタンパク質が51、減少したタンパク質が45あり、主にアミロイドーシス関連タンパク質、酸化ストレス関連タンパク質、細胞外マトリクス関連タンパク質、血管平滑筋マーカータンパク質などが変動していた。
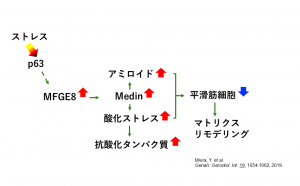
三浦氏らはこの変動タンパク質のリストから、「血管平滑筋細胞の減少により、細胞外マトリクスのリモデリングが起きるのではないか」と仮説を立て、特に変化量の大きかったアミロイドーシス関連タンパク質「MFGE8」に着目して次の研究を行った。検体数を増やし、免疫組織染色で各群のMFGE8発現量を比較すると、高齢群で有意に増加していた。MFGE8はMedinという血管アミロイドを生成する元になる物質であることが知られているため、検体にアミロイド染色を行ってみると、高齢になるほどアミロイドが蓄積していた。また、Medinは酸化ストレスを亢進するという報告があったため、酸化障害マーカータンパク質、抗酸化タンパク質の発現状態を調べたところ、いずれも高齢群で亢進していた。
次に、リレーション解析でMFGE8の上流にある分子を網羅的に検索した。ヒットしたのは「p63」というタンパク質、ただ一つだった。p63のさらに上流には多くの分子が関連していたが、そのほとんどは何らかのストレスに関係する分子だった。p63はがん細胞に発現する分子として知られているが、血管の研究では報告がなかったため、ウエスタンブロット法で大動脈内のp63発現量を調べたところ、高齢群で有意にp63が増加していた。
これらのことから、三浦氏は加齢性中膜変性症の分子メカニズムについて「加齢によって加わるさまざまなストレスによってp63の発現が増加し、それによってMFGE8の増加からMedinの増加につながり、アミロイドの蓄積や酸化ストレスの亢進が起きて血管平滑筋細胞が減少し、細胞外マトリクスのリモデリングが起きるのだろう」(図1)と述べている。
また、三浦氏らはプロテオーム解析を用いて左室駆出率が保たれた心不全(HFpEF: Heart Failure with preserved Ejection Fraction)の病態メカニズム研究も行った。拡張機能障害(IDF: Impaired Diastolic Function)の患者と健常者の心筋検体を解析したところ、IDFでは57種類のタンパク質が増減していることが分かった。そこで、この57種類のタンパク質のネットワーク解析を行ったところ、心イベントに関連するタンパク質の他に、小胞体ストレスに関係するタンパク質が高いスコアを示し、IDFの発症メカニズムに小胞体ストレスが関与している可能性が示唆された。
小胞体ストレスとは異常なタンパク質が蓄積することだが、生物には蓄積した異常なタンパク質を修復、分解したり、あるいはアポトーシスを誘導したりする小胞体ストレス応答の機能が備わっている。
「IDFでは小胞体ストレス応答に異常が生じているのではないか」と考えた三浦氏らは、IDF患者と健常者の心筋組織で小胞体ストレス応答に関連するタンパク質の変動をウエスタンブロット法で調べた。その結果、小胞体ストレス応答関連タンパク質IRE1α、GRP78、sXBP1が有意に低下していた。
「IDFの病態には小胞体ストレスが関与している可能性があり、ストレス応答能が低下している可能性が示唆された」と三浦氏は話している。
糖鎖プロファイルの変化を健康モニタリングに活用
三浦氏らの重要な研究テーマとして、長寿コホート研究を基にしたバイオマーカーの探索がある。その一つが、血漿糖鎖プロファイルの研究だ。三浦氏らはアスパラギン残基に結合するN型糖鎖を研究しているが、「N型糖鎖の合成には多数の糖転移酵素が関わり、ちょっとした反応環境の変化が多種多様な構造の糖鎖を生み出す。そのため、疾患のような健康状態の変化を反映して糖鎖の構造も変化する」と述べるとともに、「糖鎖の変化は健康状態のバロメーターになるのではないかと考えている」と研究の意義を説明する。
三浦氏によると、先人たちの研究により、①健康状態が安定しているときは個人内の糖鎖プロファイルの変動は少ないが、糖鎖プロファイルの個人差は大きい、②様々な疾患や外傷により糖鎖プロファイルは変化する、③喫煙や加齢によっても糖鎖は変化する――といったことが分かっている。
これらを踏まえて、三浦氏は「血漿糖鎖プロファイルは、継続的に個人のデータを収集する健康診断に活用するのが有用だろう」と話す。そこで、三浦氏らは同研究所と大阪大学などが共同で進めている大規模な縦断コホート研究「SONIC:the Septuagenarians, Octogenarians, Nonagenarians Investigation with Centenarians」のデータを用いた糖鎖プロファイル研究をスタートした。SONICでは初回調査の時に70歳、80歳、90歳の人をリクルートし、参加者に対して3年ごとに追跡調査を行っている。
三浦氏らはSONICのデータを用いて、糖尿病性認知機能低下を早期発見するための健康モニタリングマーカーを探索する研究に取り組んだ。認知機能検査は繰り返すと慣れが生るなどにより正確な判定が困難になるため、血液中から検出するバイオマーカーが求められている。70歳から76歳まで3年ごとに3回調査したSONICのデータから、HbA1cが3回とも6.5以上で認知機能を表すMoca-Jスコアが連続的に低下した人を解析対象者として、それぞれ個人ごとに70歳の時と76歳の時の血漿糖鎖プロファイルを比較したところ、増加7タイプ、減少14タイプの糖鎖が浮かび上がった(図2)。
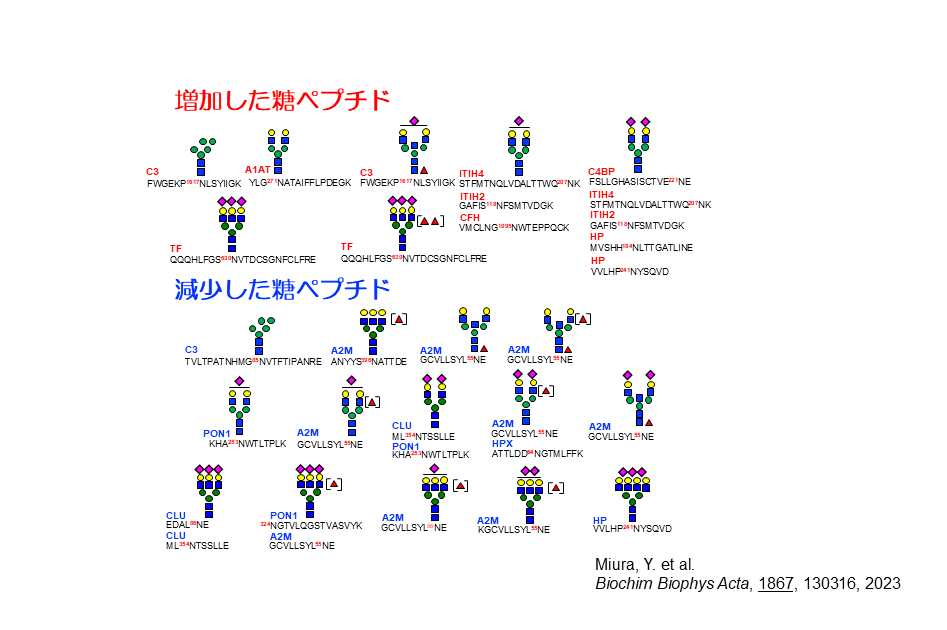
増加した糖鎖の中にはアルツハイマー病で増加することが報告されていたトランスフェリンに結合した3分岐シアル酸含有糖鎖も含まれていた。一方、減少した糖鎖の中には超百寿者に多い3分岐3シアル酸糖鎖や3分岐3シアル酸フコース含有糖鎖などが含まれていた。
三浦氏は「これらの糖鎖・糖ペプチドに着目し、LC-MS(液体クロマトグラフ質量分析法)を用いて多分子を同時にターゲット分析することで、さまざまな疾患の前兆をとらえる未来の健康診断システムが構築できるのではないか」と話している。
過去の記事
-
消化管全体の生理環境と薬物動態を考慮した革新的な薬物吸収性予測モデルを開発する

昭和薬科大学 薬学部 教授 白坂善之氏
(薬剤学研究室) -
バイオ医薬品の経口投与や効率的脳内移行を実現する「組織関門透過ペプチド」を発見

熊本大学大学院 生命科学研究部 准教授
伊藤慎悟氏 -
食品の機能性成分を分子・細胞レベルで解析し、「食による病気の予防」を目指す

群馬大学大学院 食健康科学研究科・理工学府 教授 薩秀夫氏 -
新たな遺伝子改変技術で長鎖ノックインマウスの高効率な作製に挑む

東京大学大学院農学生命科学研究科
助教 藤井渉氏 -
革新的組換えウイルス作製技術やモデル動物を駆使してプラス鎖RNAウイルスの生態を研究

九州大学 大学院医学研究院 准教授 田村友和氏