研究・開発の窓 COLUMN
製薬企業ニーズに応える国産生体模倣システムを製品化し、日本発の創薬を支援
筑波大学 生命環境学群 伊藤弓弦教授(生命地球科学研究群 生命環境系)
 動物実験では問題がなかったにもかかわらず、治験では重篤な副作用が発現することがある。データ蓄積の乏しい新たな創薬モダリティでは特にその傾向が強く、前臨床段階で毒性や有効性を精緻に予測する技術の開発が求められている。
動物実験では問題がなかったにもかかわらず、治験では重篤な副作用が発現することがある。データ蓄積の乏しい新たな創薬モダリティでは特にその傾向が強く、前臨床段階で毒性や有効性を精緻に予測する技術の開発が求められている。
筑波大学の伊藤弓弦教授を研究代表者とするAMEDの「製品化戦略に基づいた、国産MPS(Microphysiological System=生体模倣システム)による創薬プラットフォームの実証研究」は、まさに製薬企業での利用を前提とした新しい医薬品評価システムを実用化し、日本企業の国際競争力を高めるためのプロジェクトである。
伊藤教授の経歴はかなりユニークだ。東京大学理学部生物学科出身の同教授の元来の専門は発生生物学。両生類をモデルに神経や心臓の発生を研究していたが、ある時期から国際宇宙ステーションでの細胞培養実験に関わるようになった。
その後、国の研究機関である産業技術総合研究所で再生医療の基盤技術、ES細胞やiPS細胞から臓器を作製する研究に携わり、AMEDのさまざまな研究プロジェクトにも参加するようになった。2020年からは筑波大学教授とプラント建設の大手・千代田化工建設の部長代行を兼務し、教鞭を執りながら再生医療基盤技術と創薬支援技術の社会実装について共同研究を進めている。
伊藤教授は「MPSは簡単に表現すれば、再生医療の技術等を応用して、ヒトの全身を模擬的に再現したシステムのことだ」と説明する。ヒトの幹細胞やiPS細胞から培養したさまざまな臓器の細胞とそれを搭載するチップを組み合わせることで、ヒトの体内での薬物の作用や動態などを再現できる。
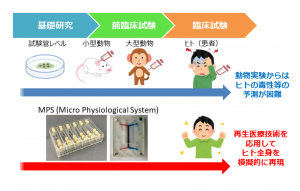
「例えば、チップの穴にヒトの細胞から培養した小腸、肝臓、心臓を並べて配置してその間を流路でつなぎ、小腸に薬を滴下してやれば、小腸から薬が吸収され、肝臓で代謝されて心臓に届くまでが再現できる。
ヒトならではの吸収や代謝、心毒性や肝毒性も小さなチップ上で評価することが可能となる。実際、実験室レベルでは臓器単体のMPSだけでなく、このような複合的なMPSも開発されてきている」と説明する伊藤教授。
さらに、「われわれのプロジェクトの目標は、このようなMPSを開発中の薬の毒性評価や疾患への有効性評価に使えるレベルまで高め、多くの製薬企業に安心して使っていただけるような環境を整えることだ」と続ける。
現在、MPSの製品化は欧米企業が先行し、日本企業は立ち遅れている。しかし、トップのEmulate社でも売上高は800万ドルほどであり、小規模な多数の企業が競い合う黎明期にある。伊藤教授は「まだ、これからの技術であり、日本が世界に追いつける可能性は十分にある」と強調する。
こうした背景から、伊藤教授らはいくつかの研究グループに分かれて、2017年度からAMEDのMPS事業に取り組んできた。第1期事業(2017年度~2021年度)では、肝臓、小腸、腎臓、脳血液関門の4領域で、臓器細胞の安定供給技術とチップ等のデバイス大量生産技術開発を並行して進め、それらを組み合わせる培養モデルを開発した。
ISOの国際エキスパートでもある伊藤教授は、過去に再生医療製品のISO規格作成に携わった経験があったことから、この事業の中でも臓器細胞の規格開発を担当した。
「アカデミアレベルでは日本でもMPSが作製されていたが、常に安定した品質で生産するためには工業的な規格化が必要だ。もう一つ重要なことは、iPS細胞由来の培養細胞で評価したデータが実際のヒトの体細胞で取ったデータと相関することを証明しなければならない。そのために肝細胞をモデルとして、生体肝移植で得られた肝細胞の提供を受けてリファレンス細胞(比較対象群)とする枠組みを構築し、実験を重ねてきた」という。
第1期事業では成果として4つの有望な国産デバイスが開発されたが、伊藤教授はそれらのデバイスとそこに搭載する臓器細胞に対するユーザーからの要求事項を基に規格化を進め、最終的にMPSを用いたアッセイ法開発のスキームを確立した。
ただ、第1期事業を終えた段階では「ラボベースではある程度の再現性のあるMPSアッセイ系が構築できたが、どこでも誰でも安定した結果が得られるところまではたどり着けなかった。次の段階でロバスト(頑健)なアッセイ系を構築することを目指さなければならない」と伊藤教授は話す。
こうして、昨年から第2期のAMED-MPS事業(2022年8月~2027年3月)がスタートした。
第2期では①革新的MPSの開発、②規格受容・国際標準化、③国産MPSの実証研究・社会実装――が事業の3本柱となっている。伊藤教授が研究代表者を務めるのは、国産MPSの実証研究・社会実装部分のプロジェクトだ。
伊藤教授は「第1期で開発された4つのMPSデバイスは、それぞれコンセプトが異なり、それゆえにかなり幅広いユーザーの要望に応えられると考えている。しかし、ユーザー(製薬企業等)とのマッチングは不十分だった。ユーザーが求める用途に合致して結果が出せるのか、どのユーザーが使っても同じ結果が出るのかなどを実証し、社会実装まで持っていくことが目標となる」と説明する。
第1期事業で開発された国産の4つのMPSのうち、すでに2つが製品化段階にある。一つは名古屋市立大学の松永民秀教授らが開発したデバイスを用いる小腸/肝・連関モデルである。
デバイス中に培地を流し、上流に腸管上皮細胞、下流に肝細胞を配することにより、薬物の腸管吸収から肝臓での代謝までの動態やバイオアベイラビリティのデータを取得できるというもので、製品化が間近い段階にある。
もう一つは、東海大学の木村啓志教授らが開発したデバイスを用いた小腸透過性モデルであり、デバイス自体はすでに上市されている。こちらは小腸単体のMPSであるが、多孔膜上に配置された腸管上皮細胞を挟んで、内腔側、血管側の2層の流路が設けられ、片方に薬物を流すことで小腸通過時の吸収性や毒性(腸管上皮細胞の構造破壊)を評価するというものだ。特に、プロドラッグのような代謝によって活性化する薬の動態や毒性を評価するには有用と思われる。
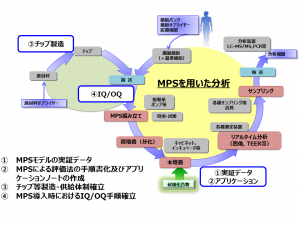
伊藤教授のAMEDプロジェクトでの役割は、これらのMPSモデルのロバストな実証データ取得、MPSによる評価法の手順書化およびアプリケーションノートの作成、チップ等の製造・共有体制の確立、MPS導入時のIQ/OQ手順確立などであり、「特にアプリケーションノートの作成に関しては、プロジェクトに参加いただいている国内の有力製薬企業の方々の希望を聞きながら実施している。良質で国内企業にアダプトするMPSを、できるだけ安価に届けることで貢献していきたい」という。
現在、日本でも肝臓、小腸、腎臓、血液脳関門だけでなく、血管、肺、神経、心筋など多様な臓器、組織の細胞を搭載したMPSが開発されてきている。
「社会実装するには安定的に均質な細胞を製造することがポイントになる」と話す伊藤教授は、「製造プロセスの中には寸分の狂いもなく厳密に管理すべき工程と、比較的許容範囲の広い工程があるが、細胞製造に関してはこうした情報やノウハウが共有されていないため、労力やコストをかけないと製造できないものになってしまっている」と指摘する。
細胞製造プロセスやMPSによる医薬品評価法などを標準化し、「誰がやっても同じ結果が出るシステム」を確立することが伊藤教授のミッションであり、「5年後には製薬企業への導入を実現し、10年後にはMPSを使った創薬が当たり前になる世界を実現したい」と展望を語る。
昨年末に米国ではFDA近代化法が成立し、動物実験代替法としてのMPSに注目が集まっている。伊藤教授は「確かに動物実験の代替という用途はあるが、MPSの本質はヒトを模倣したシステムであることだ。動物実験と同等というだけではなく、ヒトの臨床試験と同等であるという観点でもデータを蓄積し、比較していこうと思っている」と話している。
過去の記事
-
ヒト皮脂腺代替モデルを開発し、ニキビの発症や悪化のメカニズムを解明

東京薬科大学教授 佐藤隆氏(生化学教室) -
老化抑制の鍵を握るオートファジーの活性を制御し、加齢性疾患の予防や治療につなげる

奈良県立医科大学 オートファジー・抗老化研究センター長 中村修平氏 -
膜タンパク質の分解機構である「シェディング」が持つ生物学的意味を解明したい

立命館大学生命科学部教授・白壁恭子氏 -
肝がん、動脈硬化、認知症などの疾患とコンドロイチン硫酸合成異常の関連を解明

神戸薬科大学 学長・教授北川裕之氏(生化学研究室) -
製剤設計の効率化をめざし、製剤の特性をレオロジーで数値化する指標を提唱

静岡県立大学薬学部 近藤啓教授(創剤科学分野)