研究・開発の窓 COLUMN
肝細胞の3次元培養とMPSの技術開発で、病態解明や創薬を支援する
崇城大学 生物生命学部 石田誠一教授(生物生命学科 応用生命科学コース)
 薬物代謝を担う肝臓は、創薬研究でも重要な位置を占める。崇城大学の石田誠一教授は前職の国立医薬品食品衛生研究所時代から細胞の3次元培養による組織再構築を研究テーマとし、特に肝臓組織の再構築では多くの研究実績を積み重ねてきた。最近ではMPS(Micro physiological Systems:生体模倣システム)の開発を含めて、新たな視点で肝臓病の病態解明や創薬につながる支援ツールの研究に取り組んでいる。
薬物代謝を担う肝臓は、創薬研究でも重要な位置を占める。崇城大学の石田誠一教授は前職の国立医薬品食品衛生研究所時代から細胞の3次元培養による組織再構築を研究テーマとし、特に肝臓組織の再構築では多くの研究実績を積み重ねてきた。最近ではMPS(Micro physiological Systems:生体模倣システム)の開発を含めて、新たな視点で肝臓病の病態解明や創薬につながる支援ツールの研究に取り組んでいる。
肝臓の細胞には全体の約70%を占める肝実質細胞と、約30%を占める非実質細胞がある。肝実質細胞は糖や脂質の代謝や生合成、有害物質の代謝など多くの肝機能を担い、創薬の場面では薬物代謝を担う細胞として重視されている。一方、非実質細胞の一つである肝星細胞は、正常な状態(静止状態)ではビタミンAを貯蔵する機能を発揮するが、ウイルスやアルコール、薬物、肥満などで肝傷害を受けると活性化し、肝臓の線維化を進行させることが知られている。
石田教授は「肝臓は単純な構造に見えて、実は複雑な臓器だ。シャーレで2次元的に培養した肝臓の細胞は、生体の中にいるときと同じようには機能を発揮できない」と指摘する。また、肝実質細胞を2次元培養すると細胞の寿命は数日と短く、活性も低いといった問題点があるが、培養基材や培養液の工夫などにより3次元的な培養が可能になってきたことで、培養期間の長期化や活性の維持が図れるようになってきたと述べる。
また、肝星細胞はシャーレで2次元培養すると活性化した状態になり、線維芽細胞様に増殖した肝線維化・肝硬変の病態モデルしか構築できなくなってしまうという問題点があった。しかし、基材の工夫などによって肝星細胞の3次元的なスフェロイドを形成すると、生体の中と同じようにビタミンA貯蔵機能を有する静的状態の形質を持つ正常肝のモデルが構築できたという(図1)。
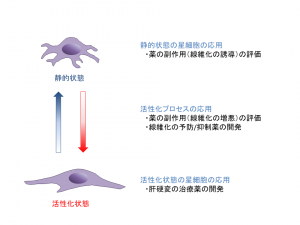
石田教授は「肝線維化の原因となるウイルス性肝炎やアルコール性肝炎はコントロール可能な疾患となってきたが、非アルコール性脂肪肝炎(NASH)は生活習慣を大きく変える以外にはコントロールする手段がない。肝星細胞の3次元的培養による評価系を構築し、肝星細胞が静的状態から活性化状態に移行するプロセスを再現することで、病態のメカニズム解明や治療薬開発につながると考えて研究を進めている」と話す。
一方、肝実質細胞を使用した実験系では、CYP3A4などの薬物代謝酵素の発現量や発現期間が重要視されているが、「肝実質細胞には不要物を胆汁として排泄する機能もあり、われわれは3次元培養技術を使って胆汁排泄の評価系を構築する研究を進めている」と石田教授は説明する。肝実質細胞の3次元的かつ長期の培養が可能になったことにより、胆汁排泄の評価に必要な毛細胆管の形成やトランスポーターの発現といった道具立てが揃ったin vitro の実験系を構築することも可能になったからだ。
薬物は最終的に肝代謝で胆汁とともに糞便に排泄、または腎から尿中に排泄されるが、「この実験系を活用することにより、肝臓に流入した化合物が胆汁排泄されるのか、血中に戻って尿排泄されるのかを評価することができるようになる」と石田教授は創薬における活用例を説明し、「これまで胆汁排泄か尿排泄かを検証するには、糞便や尿を回収して分析するか、実験動物にカニュレーションして胆汁を回収して分析する方法しかなかったため、in vitroの胆汁排泄評価系は医薬品開発の期間短縮や低コスト化、動物実験の適正化などの面で貢献できると思う」と期待を示す。
また、ヒトiPS細胞由来の肝細胞は、肝臓から採取した肝細胞に比べてCYP3A4の活性が低いため、これまでは医薬品開発ではあまり活用されていなかったが、石田教授らはiPS細胞由来肝細胞が3次元培養で毛細胆管を安定的に形成することを見い出している。
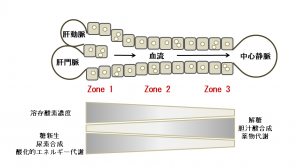
さらに、石田教授はヒト肝細胞を使ったMPS(生体模倣システム)の開発を進めている。これまでMPSならではの長所として、複数の臓器細胞の連関や細胞のシェアストレス(液体の流れにより生じる物理的な刺激)に対する反応が再現できることが強調されてきたが、石田教授らは臓器内を流れる物質の濃度勾配に着目したMPSを開発している。チップ上にヒト肝細胞を一列に配置し、門脈から血液とともに薬剤が流れ込み、肝細胞で代謝を受け、中心静脈側もしくは胆管側に流出する肝臓の類洞構造を模倣したもの(図2)で、流路を灌流する物質の濃度勾配まで再現できる。
「肝臓では門脈側は血液中の溶存酸素濃度が高く、中心静脈側は低い。老廃物の濃度やCYP3A4の発現量は門脈側が低く、中心静脈側が高い。それに応じて門脈側と中心静脈側では同じ細胞でも働きに違いが出たり、同じ薬物に対しても傷害を受ける程度が違ったりすることが知られているが、われわれのMPSはそうした生体内での現象もチップ上で再現できる」と石田教授は特徴を説明し、「科学的に興味深い実験が行えるだけでなく、医薬品開発においては肝毒性を検証する動物実験の部分が、MPSによる実験に置き換えられるかもしれないと考えている」と話している。
石田教授は現在、AMEDの「MPSの標準化・基準作成による産業界への導入と規制当局受け入れとの橋渡し研究」と「生体模倣システム(MPS)の新規ヒト型in vitro医薬品評価法としての規格化、国際標準化に向けた基盤整備に資する研究」の研究代表者を務めているが、MPSの標準化には多くの課題があると指摘する。例えば、MPSの多くは流路に液体培地を流すことで血流を再現し、同時に細胞を培養して組み合わせる構造になっているが、そのMPSにとってどのぐらいの流速で培地を流すことが適切であるかはあまり深く検証されていない。
また、複数の種類の細胞を組み合わせてMPSを構築する際は、それぞれの細胞で培養に最適な条件が異なるため、均一に安定して培養するのには高い技術が必要になる。実験室で試行錯誤している段階ではそれでも問題はないが、製品化されたMPSを製薬企業等が利用する際には、誰が行っても同じように細胞が培養でき、安定的な実験結果が得られるような再現性の高いシステムが求められる。石田教授は「規制当局側もデータの再現性を重視すると思われるため、われわれの研究室では肝細胞培養系のMPS開発を通して、できるだけシンプルな構造で操作性やデータの再現性が高いMPSを構築することを目指している」と述べる。
最後に石田教授は、MPS開発の方向性やビジネスモデルに関して、「欧米のベンチャー企業は1つの薬剤の開発や1回限りの病態解明に特化したオーダーメイドなMPSを次々に開発していく戦略を採っているように見えるが、それでは非常にコストの高いものになってしまう。個人的な見解だが、多くの製薬企業や化学メーカーが長期的に継続使用できるような汎用性の高いMPSを開発、販売するビジネスモデルの方が、日本には合っているような気がする」と展望を語った。
過去の記事
-
薬物の代謝速度や相互作用に関与する小胞体膜トランスポーターの機能を解明する

名古屋市立大学大学院 薬学研究科 教授
荒川大氏 -
消化管全体の生理環境と薬物動態を考慮した革新的な薬物吸収性予測モデルを開発する

昭和薬科大学 薬学部 教授 白坂善之氏
(薬剤学研究室) -
プロテオーム解析を起点に老化関連疾患の病態機序や健康長寿の因子を探索

東京都健康長寿医療センター研究所 研究部長 三浦ゆり氏(老化機構研究チーム プロテオーム研究) -
バイオ医薬品の経口投与や効率的脳内移行を実現する「組織関門透過ペプチド」を発見

熊本大学大学院 生命科学研究部 准教授
伊藤慎悟氏 -
食品の機能性成分を分子・細胞レベルで解析し、「食による病気の予防」を目指す

群馬大学大学院 食健康科学研究科・理工学府 教授 薩秀夫氏




